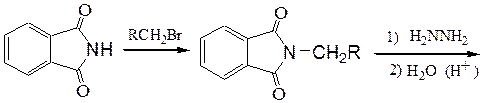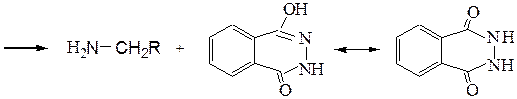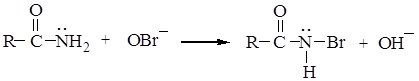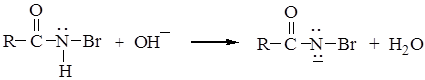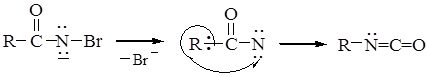Получение.
1. Реакции нуклеофильного замещения (методы алкилирования ). а) Аммонолиз и аминолиз алкилгалогенидов. При взаимодействии аммиака с алкилгалогенидами (аммонолиз) образуются первичные амины:
+ NH3 NH3 + R–Br ¾¾® [ R–NH3 ] Br – ¾¾¾¾® R–NH2 (– NH4Br)
Первичный амин, будучи более сильным нуклеофилом, чем аммиак, вступает с ним в конкуренцию и реагирует со следующей молекулой алкилгалогенида (аминолиз). Образующаяся замещенная аммониевая соль, как и в предыдущем случае разлагается аммиаком:
+ NH3 R–NH2 + R–Br ¾¾® [ R2NH2 ] Br – ¾¾¾¾® R2NH (– NH4Br)
Аналогично реагирует вторичный амин:
+ NH3 R2NH + R–Br ¾¾® [ R3NH ] Br – ¾¾¾¾® R3N (– NH4Br)
Третичный амин также способен алкилироваться галогеналканом, образуя четвертичную аммониевую соль, которая не разлагается аммиаком: + R3N + R–Br ¾¾® [ R4N ] Br –
Таким образом, реакция приводит к смеси первичного, вторичного, третичного аминов и четвертичной аммониевой соли. Аналогичный результат дает алкилирование аммиака и аминов спиртами, однако эта реакция идет только при 300 0C в присутствии катализатора Al2O3. б) Первичные амины синтезируют алкилированием фталимида в присутствии основания по методу Габриэля:
Гидролиз N-фталимидных производных осуществляется нагреванием со щелочами, кислотами или лучше всего с гидразин-гидратом. 2. Восстановление других азотсодержащих функциональных органических соединений – альдиминов (кетиминов),оксимов, оснований Шиффа, нитрилов, амидов карбоновых кислот, нитросоединений и т.д.:
3. Перегруппировка амидов карбоновых кислот по Гофману:
Механизм реакции состоит из следующих стадий: а) галогенирование амида карбоновой кислоты
б) отрыв иона водорода гидроксил-ионом. Эта стадия облегчается электроноакцепторным влиянием атома брома, увеличивающим кислотность амида.
в)удаление аниона брома, приводящее к возникновению электронодефицитного атома азота и перегруппировка
г) гидролиз изоцианата
По аналогичной схеме протекают перегруппировки азидов RCON3 (перегруппировка Курциуса) и гидрoксамовых кислот RCONHOH (перегруппировка Лоссена) в первичные амины. 4. Декарбоксилирование α-аминокислот имеет малое значение для химии, но широко распространено в биологических объектах. При декарбоксилировании a-аминокислот образуются биогенные амины, выполняющие в организме важные биологические функции. Так, получающийся при декарбоксилировании гистидина гистамин, в частности, имеет отношение к аллергическим реакциям организма.
R–CH–COOH ¾¾® R–CH2–NH2 + CO2 | NH2 Химическоедекарбоксилирование карбоновых кислот обычно протекает легко в том случае, если при a-углеродном атоме имеется электроноакцепторный заместитель, поляризующий связь С-СООН. В a-аминокислотах такой группировкой служит +NH3-группа. Декарбоксилирование a-аминокислот - путь образования биогенных аминов. В живом организме этот процесс проходит под действием декарбоксилазы и пиридоксальфосфата. В лабораторных условиях реакцию осуществляют при нагревании a-аминокислоты в присутствии поглотителей СО2, таких, как Ва(ОН)2. При декарбоксилировании b-фенил-a-аланина, лизина, серина и гистидина образуются соответственно фенамин, 1,5диаминопентан (кадаверин), 2-аминоэтанол-1 (коламин) и триптамин.
|