ЧАСТЬ II ДВИГАТЕЛЬНЫЕ И ИНТЕГРАТИВНЫЕ ФУНКЦИИ НЕРВНОЙ СИСТЕМЫ
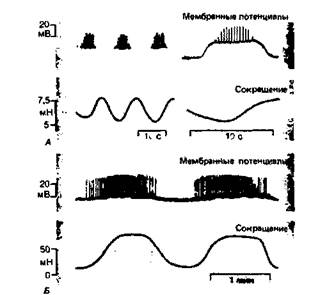
ца ведет себя как единая функциональная единица, почти синхронно воспроизводя активность своего пейсмекера. Миогениые ритмы. Флуктуации миогенного тонуса с периодами по нескольку секунд или минут обусловлены спонтанными изменениями активности пейсмекерных клеток. Когда мембрана такой клетки деполяризована в течение нескольких секунд или минут, возникает разряд потенциалов действия, ведущий к тетаническому сокращению. Голенхофен [6] различает здесь относительно короткие органоспецифичные и более длительные минутные ритмы («медленные волны»). В гладких мышцах привратника желудка (рис. 4.16, Л) эти волны короче и четче, чем в мышцах толстой кишки (рис. 4.16, Б). Пока неясно, обусловлены ли медленные колебания мембранного потенциала (волны деполяризации) ритмичной активностью электрогенного натриевого насоса. Реакции гладких мышц на растяжение. В отличие от скелетных мышц большинство гладких при растяжении часто ведут себя не как более или менее упругие, а как пластичные или вязкоупругие тела. После начального роста напряжения, обусловленного упругими свойствами, они становятся пластично податливыми; во время этой следующей за растя-
жением фазы напряжение сначала быстро, а затем медленнее падает (рис. 4.17). Благодаря своей пластичности гладкая мышца может быть полностью расслаблена как в укороченном, так и в растянутом состоянии. Например, пластичность мочевого пузыря по мере его наполнения предотвращает избыточный рост внутрипузырного давления. Во многих случаях сильное растяжение ведет к активации сокращения (рис. 4.17), накладывающегося на только что описанный пассивный процесс. Оно обусловлено нарастающей при растяжении мышцы деполяризацией пейсмекерных клеток, которая повышает частоту потенциалов действия. Как говорилось выше, повышение частоты разряда усиливает сокращение. Сокращение, активируемое растяжением, играет важную роль в ауторегуляции тонуса артериол (с. 528), а также обеспечивает автоматическое опорожнение наполнившегося мочевого пузыря в тех случаях, когда нервная регуляция этого процесса отсутствует в результате повреждения спинного мозга. ГЛАВА 4. МЫШЦА 87 Гладкие мышцы, не обладающие спонтанной активностью. У гладких мышц артерий, семенных протоков, радужки, а также у ресничных мышц спонтанная активность обычно слабая или ее вообще нет. В отличие от мышц кишечника природа их активности часто не миогенная, а нейрогенная, т. е. обусловлена импульсами, которые поступают к этим мышцам по вегетативным нервам. Такие особенности обусловлены структурной организацией их ткани. Хотя клетки в ней электрически связаны нексусами, многие из них образуют прямые синаптические контакты с иннервирующими их аксонами (ср. с. 351). Медиаторы, высвобождаемые при поступлении нервного импульса, достигают путем диффузии эффекторных клеток и активируют их. При этом в мышечных клетках, например артериол или семенных протоков, возникают нейрогенные препотенциалы, за которыми следуют потенциалы действия, вызывающие тетанообразное сокращение. Нанесенный прямо на изолированную мышцу сосуда норадреналин вызывает стойкое сокращение (контрактуру): мембрана клетки (исключениегладкие мышцы легочных и ушных артерий) деполяризуется на весь период действия этого медиатора. Электромеханическое сопряжение. Возбуждение гладкомышечных клеток вызывает либо увеличение входа Са2+ через потенпиалзависимые кальциевые каналы клеточной мембраны, либо высвобождение Са2+ из саркоплазматического ретикулума под влиянием внутриклеточного «второго посредника» инозитолтрифосфата. В обоих случаях повышается концентрация Са2+ в саркоплазме и, следовательно, активируются сократительные структуры. Подобно сердечной и скелетной мускулатуре, гладкие мышцы всегда расслабляются при падении внутриклеточной концентрации Са2+ ниже 10−7 М. Однако их расслабление происходит гораздо медленнее, поскольку скорость поглощения ионов Са2+ саркоплазматическим ретикулумом или удаления их через клеточную мембрану здесь ниже. Удаление Са2+ приводит к расщеплению фосфатазой функционально важной фосфатной группы миозина. Его дефосфорилированные головки теряют способность образовывать поперечные мостики с актином. В начале сокращения ионы Са2+. высвобожденные из саркоплазматического ретикулума, активируют при участии Ca2+-связывающего белка кальмодулина особый фермент-киназу легких цепей миозина, переносящий фосфатную группу с АТФ на миозин. Такое фосфорилирование запускает взаимодействие актина с миозином, а значит, и сокращение. Пока неясно, участвуют ли в регуляции сокращения гладкой мышцы другие кальциевые «переключатели». Не выяснено также, каким образом образующиеся в гладкомышечных клетках цАМФ и цГМФ вызыва- ют понижение их тонуса. Возможно, цАМФ ингибирует активность киназы легких цепей миозина или усиливает поглощение Са2+ саркоплазматическим ретикулумом. С другой стороны, вполне вероятна роль цГМФ как внутриклеточного посредника в расслаблении гладких мышц сосудов, которое индуцируется расслабляющим фактором эндотелия [3]. Литература
|