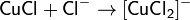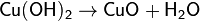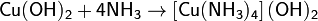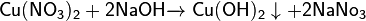Металлическая медь, ее получение, свойства, применение
Получение: Его можно упрощенно представить следующим образом: вначале сульфид меди (например, Cu2S) подвергают окислительному обжигу: Свойства металлической меди 2Cu + O2 4Cu + O2 Cu + Cl2 Cu + 2H2SO4 (конц.) Cu + 4HNO3 (конц.) 3Cu + 8HNO3 (разб.) Сu + 2FeCl3(р-р.) = CuCl2(р-р.) + 2FeCl2(р-р.) Применение: Более половины добываемой меди используется в электротехнике для изготовления различных проводов, кабелей, токопроводящих частей электротехнической аппаратуры. Из-за высокой теплопроводности медь — незаменимый материал различных теплообменников и холодильной аппаратуры. Широко применяется медь в гальванотехнике — для нанесения медных покрытий, для получения тонкостенных изделий сложной формы, для изготовления клише в полиграфии и др.
Соединения меди(I) Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета. Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства. Многие соединения меди +1 имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе Сu+ все пять Зd-орбиталей заполнены парами электронов. Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют:
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]− устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl, CuBr и CuI нерастворимы. Также существует нестабильный сульфат меди(I).
Соединения меди(II) Степень окисления II — наиболее стабильная степень окисления меди. Ей соответствует чёрный оксид CuO и голубой гидроксид Cu(OH)2, который при стоянии легко отщепляет воду и при этом чернеет:
Гидроксид меди (II) носит преимущественно основный характер и только в концентрированной щелочи частично растворяется с образованием синего гидроксокомплекса. Наибольшее значение имеет реакция гидроксида меди (II) с водным раствором аммиака, про которой образуется так называемый реактив Швейцера (растворительцеллюлозы):
Соли меди(II) образуются при растворении меди в кислотах-окислителях (азотной, концентрированной серной). Большинство солей в этой степени окисления имеют синюю или зелёную окраску. Соединения меди(II) обладают слабыми окислительными свойствами. Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Оксид меди (II) используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Оксиды меди: Оксид меди (I) Cu2O3 и закись меди (I) Cu2O, как и другие соединения меди (I) менее устойчивы, чем соединения меди (II). Оксид меди (I), или закись меди Cu2O в природе встречается в виде минерала куприта. Кроме того, она может быть получена в виде осадка красного оксида меди (I) в результате нагревания раствора соли меди (II) и щелочи в присутствии сильного восстановителя. Оксид меди (II), или окись меди, CuO - черное вещество, встречающееся в природе (например в виде минерала тенерита). Его получают прокаливанием гидроксокарбоната меди (II) (CuOH)2CO3 или нитрата меди (II) Cu(NO2)2. Гидроксид меди(II) — Cu(ОН)2, голубое аморфное или кристаллическое вещество. Cu(ОН)2 практически не растворим в воде. В лаборатории получают действием на холоде растворимых гидроксидов, кроме NH4OH, на растворимые соли меди, например:
Является амфотерным гидроксидом. Реагирует с кислотами с образованием воды и соответствующей соли меди:
С разбавленными растворами щелочей не реагирует, в концентрированных растворяется, образуя ярко-синие тетрагидроксокупраты (II):
Как и все нерастворимые основания, гидроксид меди II при нагревании разлагается на оксид и воду, в данном случае, на оксид меди(II):
При длительном стоянии на воздухе, обогащённым кислородом, гидроксид меди (II) вступает в обратимую реакцию с кислородом, образуя грязно-красный оксид меди (III):
Равновесие в этой реакции сдвинуто влево. При избытке влаги может образоваться гидроксид куприла (III):
Очень легко растворяется в избытке аммиака с образованием аммиаката меди:
или
|

 2CuO
2CuO 2Cu2O
2Cu2O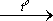 CuCl2
CuCl2