Получение и свойства металлического марганца
Основная литература 1. Ионин А.А. и др. Теплоснабжение - М.: Стройиздат, 1982. -336 с. 2. Соколов Е.А. Теплофикация и тепловые сети. 5-изд. - М.: Энергоиздат, 1982. -360 с. 3. СНиП-2.04.07-86*. Тепловые сети. Минстрой России - М.: ГП ЦПИ, 1994. -48 с. Дополнительная литература: 1. СНиП РК 2.04.01-2001 Строительная климатология. КДС МЭиТ РК..Астана, 2002.-113с. 2. СНиП-2.04.01-85*. Внутренний водопровод и канализация зданий. Минстрой России - М.: ГУП ЦПП, 1996. - 60 с. 3. Апарцев М.М. Наладка водяных систем централизованного теплоснабжения. Справочное пособие. - М.: Энергоатомиздат, 1983. -204 с. 4. Манюк В.И. и др. Справочник по наладке и эксплуатации водяных тепловых сетей. - 3-изд. - М.: Стройиздат, 1988. -232 с. 5. Справочник проектировщика. Внутренние санитарно-технические устройства. Ч.2. Водопровод и канализация. Под ред. И.Г. Староверова, Ю.И.Шиллера. 4-е изд. перераб. и доп - М.: Стройиздат, 1990. -247 с. 6. Козин В.Е. и др. Теплоснабжение Уч. пособие. - М.: Высшая школа, 1980. -408 с. 7. Зингер Н.М. Гидравлические и тепловые режимы теплофикационных сетей - М.: Энергоатомиздат, 1986. -319 с. 8. Водяные тепловые сети. Справочное пособие по проектированию. Под. ред. Н.К.Громова, Е.П.Шубина. М.: Энергоатомиздат,1986.- 376с.
Тема 25. Общая характеристика элементов Элементы 7В-группы-марганец, технеций, рений-завершают первые пятерки вставных декад d-элементов. Их валентная электронная конфигурация (n-1)d5ns2 позволяет сделать вывод об относительной стабильности степени окисления +2, поскольку наполовину заполненная d-оболочка отличается повышенной устойчивостью. Марганец Марганец представляет собой серебристо-белый твердый, но хрупкийметалл. Его хрупкость объясняется тем, что при нормальных температурах вэлементарную ячейку Mn входит 58 атомов в сложной ажурной структуре, неотносящейся к числу плотноупакованных. Плотность Марганца 7.44 г/см3,температура плавления 1244оС, температура кипения 2150оС. В реакциях проявляет валентность от 2 до 7, наиболее устойчивые степениокисления +2,+4,+7.Природные соединения Основным природным соединением марганца является минерал пиролюзит MnO2*xH2O-гидратированный оксид марганца (+4) серо-черного цвета. Марганец часто встречается совместно с железом в оксидных, карбонатных и сульфидных рудах: гаусманит Mn3O4 совместно с магнитным железняком Fe3O4, биксбит представляет собой смешанный оксид марганца и железа (Mn, Fe)2O3, родохрозит MnCO3 встречается совместно с сидеритом FeCO3, марганцевая обманка MnS совместно с пирротином FeS, марганцевый колчедан MnS2 совместно с железным колчеданом FeS2.
Получение и свойства металлического марганца Основная масса металлического марганца в настоящее время получается путем алюмотермического восстановления пиролюзита, гаусманита или предварительно обожженных карбонатных и сульфидных руд: 3Mn3O4+8Al=9Mn+4Al2O3 Также если необходимо получить чистый металлический марганец, его получают электролизом водного раствора сульфата марганца(II). Свойства металлического марганца: 2Mn + O2 Mn + Cl2 Mn + H2SO4 (разб.) Mn + 2HCl Mn + 2H2SO4 (конц.) = MnSO4 + SO2 + 2H2O Mn + 4HNO3 (конц.) = Mn(NO3)2 + 2NO2 + 2H2O
Соединения марганца(II) Соли двухвалентного марганца можно получить при растворении в разбавленных кислотах: Mn+2HCl MnCl2+H2 При растворении в воде образуется гидроксид Mn(II): Mn+2HOH MnCl2+H2 При растворении в воде образуется гидроксид Mn(II): Mn+2HOH  Mn(OH)2+H2 Гидроксид марганца можно получить в виде белого осадка при действии на растворы солей двухвалентногомарганца щелочью: MnSO4+2NaOH Mn(OH)2+H2 Гидроксид марганца можно получить в виде белого осадка при действии на растворы солей двухвалентногомарганца щелочью: MnSO4+2NaOH  Mn(OH)2 +NaSO4 Соединения Mn(II) на воздухе неустойчивы, и Mn(OH)2 на воздухебыстро буреет, превращаясь в оксид-гидроксид четырёхвалентного марганца. 2Mn(OH)2+O2 Mn(OH)2 +NaSO4 Соединения Mn(II) на воздухе неустойчивы, и Mn(OH)2 на воздухебыстро буреет, превращаясь в оксид-гидроксид четырёхвалентного марганца. 2Mn(OH)2+O2  MnO(OH)2 Гидроксид марганца проявляет только основные свойства и не реагирует сощелочами, а при взаимодействии с кислотами даёт соответствующие соли. Mn(OH)2+2HCl MnO(OH)2 Гидроксид марганца проявляет только основные свойства и не реагирует сощелочами, а при взаимодействии с кислотами даёт соответствующие соли. Mn(OH)2+2HCl  MnCl2+2H2O Оксид марганца может быть получен при разложении карбоната марганца: MnCO3 MnCl2+2H2O Оксид марганца может быть получен при разложении карбоната марганца: MnCO3  MnO+CO2 Либо при восстановлении диоксида марганца водородом: MnO2+H2 MnO+CO2 Либо при восстановлении диоксида марганца водородом: MnO2+H2  MnO+H2OОкси́д ма́рганца(II) — MnO — низший оксид марганца, монооксид. Хим.свойства: Не растворим в воде. Легко окисляется с образованием хрупкой оболочки MnO2. Восстанавливается до марганца при нагревании с водородом или активными металлами. Получение:Оксид марганца(II) можно получить прокаливанием при температуре 300 °C кислородсодержащих солей марганца(II) в атмосфере инертного газа. Из распространённого MnO2 его получают через частичное восстановление при температурах 700-900 °C водородом или угарным газом. Гидроксид марганца(II) — неорганическое соединение, гидроокись металла марганца с формулой Mn(OH)2, студнеобразный светло-розовый осадок. Нерастворим в воде. Проявляет слабо основные свойства. Окисляется на воздухе. Хим.свойства: MnO+H2OОкси́д ма́рганца(II) — MnO — низший оксид марганца, монооксид. Хим.свойства: Не растворим в воде. Легко окисляется с образованием хрупкой оболочки MnO2. Восстанавливается до марганца при нагревании с водородом или активными металлами. Получение:Оксид марганца(II) можно получить прокаливанием при температуре 300 °C кислородсодержащих солей марганца(II) в атмосфере инертного газа. Из распространённого MnO2 его получают через частичное восстановление при температурах 700-900 °C водородом или угарным газом. Гидроксид марганца(II) — неорганическое соединение, гидроокись металла марганца с формулой Mn(OH)2, студнеобразный светло-розовый осадок. Нерастворим в воде. Проявляет слабо основные свойства. Окисляется на воздухе. Хим.свойства: Гидроксид марганца (II) легко окисляется на воздухе до бурого оксогидроксида марганца, который далее разлагается на оксид марганца (IV):
Гидроксид марганца (II) обладает основными свойствами. Он реагирует с кислотами и кислотными оксидами:
Гидроксид марганца (II) обладает восстановительными свойствами. В присутствии сильных окислителей он может окисляться до перманганата:
Получение: Образуется гидроксид марганца (II) при взаимодействии его солей со щелочами:
Сульфат марганца (II) MnSO4 — соль белого цвета, одно из наиболее устойчивых соединений марганца (II). В виде кристаллогидрата MnSO4•7Н2O встречается в природе. Он используется при крашении тканей, а также наряду с хлоридом марганца (II) MnСl2 — для получения других соединений марганца. Карбонат марганца (II) MnСO3 встречается в природе в виде марганцевого пшата и используется в металлургии. Нитрат марганца (II) Mn(NO3)2 получают только искусственным путем и используют для разделения редкоземельных металлов. В окислительно-восстановительных реакциях соединения марганца (II) — хорошие восстановители. Соединения марганца (III). Гидроксид, соли марганца (III). Если длительно нагревать MnO2 на воздухе, образуется оксид марганца (+3):4MnO2=2Mn2O3+O2Оксид Mn2O3 можно получить и окислением MnO на воздухе при 300 градусах.Гидроксид Mn(OH)3 характеризуются преимущественно основным характером, хотя в жестких условиях(сильное и длительное кипячение с растворами щелочей) он проявляет некоторые признаки амфотерности, образуя анионные гидроксокомплексы. В кислой среде он легко образует аквакомплексы и соответствующие соли Mn(+3), причем они малохарактерны для марганца.Из галогенидов, отвечающих степени окисления марганца +3, известны фториды и хлориды, которые сильно различаются по устойчивости. Красные кристаллы MnF3 начинают разлагаться на MnF2 и F2 лишь при температуре более 600 градусов. В противоположность этому хлорид марганца(+3) в свободном состоянии не выделен и известен в виде двойных солей MnCl3*3KCl или MnCl3*2KCl..Солеобразные соединения Mn(+3) характеризуются неустойчивостью. В водных растворах они легко гидролизуются, диспропорционируют по схеме 2Mn(+3)= Mn(+2)+ Mn(+4). В присутствии окислителей и восстановителей легко переходят в соединения марганца с более высокой и более низкой степенью окисления. В кислой среде Mn(+3) довольно сильный окислитель. В нейтральных и щелочных средах Mn(+3)-восстановитель. Стабильность Mn(+3) повышается за счет комплексообразования. Если сульфат марганца(+3) неустойчив, то комплекс, двойные соли типа квасцов вполне стабильны. Соединения марганца (IV) Из соединений четырёхвалентного марганца наиболее известен диоксид марганца MnO2 - пиролюзит. Поскольку валентность IV является промежуточной, соединения Mn (VI)образуются как при окислении двухвалентного марганца. Mn(NO3)2  MnO2+2NO2 Так и при восстановлении соединений марганца в щелочной среде: 3K2MnO4+2H2O MnO2+2NO2 Так и при восстановлении соединений марганца в щелочной среде: 3K2MnO4+2H2O  2KMnO4+MnO2+4KOH Последняя реакция является примером реакции самоокисления -самовосстановления, для которых характерно то, что часть атомов одного и тогоже элемента окисляется, восстанавливая одновременно оставшиеся атомы того жеэлемента: Mn6++2e=Mn4+ 1 Mn6+ - e=Mn7+ 2 В свою очередь MnО2 может окислять галогениды и галоген водороды, например HCl: MnO2+4HCl 2KMnO4+MnO2+4KOH Последняя реакция является примером реакции самоокисления -самовосстановления, для которых характерно то, что часть атомов одного и тогоже элемента окисляется, восстанавливая одновременно оставшиеся атомы того жеэлемента: Mn6++2e=Mn4+ 1 Mn6+ - e=Mn7+ 2 В свою очередь MnО2 может окислять галогениды и галоген водороды, например HCl: MnO2+4HCl  MnCl2+Cl2+2H2O Диоксид марганца - твёрдое порошкообразное вещество. Он проявляет какосновные, так и кислотные свойства Оксид марганца(IV) (диоксид марганца) MnO2 — порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко распространённое в земной коре (минерал пиролюзит).Строение: черные тетрагональные кристаллы MnCl2+Cl2+2H2O Диоксид марганца - твёрдое порошкообразное вещество. Он проявляет какосновные, так и кислотные свойства Оксид марганца(IV) (диоксид марганца) MnO2 — порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко распространённое в земной коре (минерал пиролюзит).Строение: черные тетрагональные кристаллы Хим.свойства: При обычных условиях ведет себя довольно инертно. При нагревании с кислотами проявляет окислительные свойства, например, окисляет концентрированную соляную кислоту до хлора:
С серной и азотной кислотами MnO2 разлагается с выделением кислорода:
При взаимодействии с сильными окислителями диоксид марганца окисляется до соединений Mn7+ и Mn6+:
Диоксид марганца проявляет амфотерные свойства. Так, при окислении сернокислого раствора соли MnSO4 перманганатом калия в присутствии серной кислоты образуется чёрный осадок соли Mn(SO4)2.
При сплавлении с щелочами и основными оксидами MnO2 выступает в роли кислотного оксида, образуя соли манганиты:
Является катализатором разложения пероксида водорода:
Нахождение в природе: Исходный продукт для получения марганца и его соединений. MnO2 применяется в производстве элементов Лекланше, катализаторов, как окислитель Манганиты Соли, отвечающие кислотным свойствам Mn(OH)4, называют манганитами, а сам гидроксид в этом случае рассматривается как марганцоватистая кислота. Соли получают как нейтрализацией растворов, так и сухим путем (прокаливанием MnO2 с оксидами металлов):Mn(OH)4+2KOH=K2MnO3+3H2OMnO2+BaO=BaMnO3Манганиты неустойчивы и их трудно выделить в чистом виде. С химической точки зрения оксид Mn3O4 является манганитом марганца(+2). Соединения шестивалентного марганца. При сплавлении MnO2 со щелочами в присутствии кислорода, воздухаили окислителей получают соли шестивалентного Марганца, называемые манганатами. MnO 2 +2KOH+KNO 3 K 2 MnO 2 +KNO 2 +H 2 O Соединений марганца шестивалентного известно немного, и из них наибольшеезначение соли марганцевой кислоты - манганаты. Сама марганцевая кислота, как и соответствующей ей триоксид марганца MnO3, в свободном виде не существует вследствии неустойчивости к процессамокисления - восстановления. Замена протона в кислоте на катион металла приводитк устойчивости манганатов, но их способность к процессам окисления -восстановления сохраняется. Растворы манганатов окрашены в зелёный цвет. При ихподкислении образуется марганцеватая кислота, разлагается до соединений марганцачетырёхвалентного и семивалентного. Сильные окислители переводят марганец шестивалентный в семивалентный. 2K2MnO 4 +Cl2 2 K 2 MnO 2 +KNO 2 +H 2 O Соединений марганца шестивалентного известно немного, и из них наибольшеезначение соли марганцевой кислоты - манганаты. Сама марганцевая кислота, как и соответствующей ей триоксид марганца MnO3, в свободном виде не существует вследствии неустойчивости к процессамокисления - восстановления. Замена протона в кислоте на катион металла приводитк устойчивости манганатов, но их способность к процессам окисления -восстановления сохраняется. Растворы манганатов окрашены в зелёный цвет. При ихподкислении образуется марганцеватая кислота, разлагается до соединений марганцачетырёхвалентного и семивалентного. Сильные окислители переводят марганец шестивалентный в семивалентный. 2K2MnO 4 +Cl2 2  2KMnO 4 +2KCl Соединения семивалентного марганца. В семивалентном состоянии марганец проявляет только окислительные свойства.Среди применяемых в лабораторной практике и в промышленности окислителей широкоприменяется перманганат калия KMnO2, в быту называемый марганцовкой.Перманганат калия представляет собой кристаллы чёрно-фиолетового цвета. Водныерастворы окрашены в фиолетовый цвет, характерный для иона MnO4- Перманганаты являются солями марганцевой кислоты, которая устойчива только вразбавленных растворах (до 20%). Эти растворы могут быть получены действиемсильных окислителей на соединения марганца двухвалентного: 2Mn(NO 3 ) 2 +PbO 2 +6HNO 3 2KMnO 4 +2KCl Соединения семивалентного марганца. В семивалентном состоянии марганец проявляет только окислительные свойства.Среди применяемых в лабораторной практике и в промышленности окислителей широкоприменяется перманганат калия KMnO2, в быту называемый марганцовкой.Перманганат калия представляет собой кристаллы чёрно-фиолетового цвета. Водныерастворы окрашены в фиолетовый цвет, характерный для иона MnO4- Перманганаты являются солями марганцевой кислоты, которая устойчива только вразбавленных растворах (до 20%). Эти растворы могут быть получены действиемсильных окислителей на соединения марганца двухвалентного: 2Mn(NO 3 ) 2 +PbO 2 +6HNO 3  2HMnO 4 +5Pb(NO 3 ) 2 + 2H 2 O При концентрации HMnO4 выше 20% происходит разложение её по уравнению: 4HMnO 4 2HMnO 4 +5Pb(NO 3 ) 2 + 2H 2 O При концентрации HMnO4 выше 20% происходит разложение её по уравнению: 4HMnO 4  4MnO+3O 2 +2H 2 O Соответствующий марганцевой кислоте марганцевый ангидрид, или оксид марганца(VII), Mn2O7 может быть получен путем воздействия концентрированной серной кислоты на перманганат калия. Этот оксид является ещё более сильным окислителем, чем HMnO4 и KMnO4.Органические соединения при с Mn2O2 самовоспламеняются. При растворении Mn2O2 в воде образуется марганцевая кислота. Из-за неустойчивости и крайне высокой реакционной способности Mn2O2 не применяют, а вместо него используют твердые перманганаты. В зависимости от среды перманганат калия может восстанавливаться до различныхсоединений. При нагревании сухого перманганата калия до температуры выше 200 ОС он разлагается. 2KMnO4 4MnO+3O 2 +2H 2 O Соответствующий марганцевой кислоте марганцевый ангидрид, или оксид марганца(VII), Mn2O7 может быть получен путем воздействия концентрированной серной кислоты на перманганат калия. Этот оксид является ещё более сильным окислителем, чем HMnO4 и KMnO4.Органические соединения при с Mn2O2 самовоспламеняются. При растворении Mn2O2 в воде образуется марганцевая кислота. Из-за неустойчивости и крайне высокой реакционной способности Mn2O2 не применяют, а вместо него используют твердые перманганаты. В зависимости от среды перманганат калия может восстанавливаться до различныхсоединений. При нагревании сухого перманганата калия до температуры выше 200 ОС он разлагается. 2KMnO4  K2MnO4 + MnO2 + O2 Этой реакцией в лаборатории иногда пользуются для получения кислорода. Марганцовистая и марганцовая кислоты. Манганаты и перманганаты. K2MnO4 + MnO2 + O2 Этой реакцией в лаборатории иногда пользуются для получения кислорода. Марганцовистая и марганцовая кислоты. Манганаты и перманганаты. Марганцу отвечает несколько кислот, из которых наиболее важны сильные неустойчивые марганцовистая кислота H2MnO4 и марганцовая кислота HMnO4, соли которых — соответственно, манганаты (например, манганат натрия Na2MnO4) и перманганаты (например, перманганат калия KMnO4). Манганаты (известны манганаты только щелочных металлов и бария) могут проявлять свойства как окислителей (чаще) 2NaI + Na2MnO4 + 2H2O = MnO2 + I2 + 4NaOH, так и восстановителей 2K2MnO4 + Cl2 = 2KMnO4 + 2KCl. В водных растворах манганаты диспропорционируют на соединения марганца (+4) и марганца (+7): 3K2MnO4 + 3Н2О = 2KMnO4 + MnO2·Н2О + 4КОН. При этом окраска раствора из зеленой переходит в синюю, затем в фиолетовую и малиновую. За способность изменять окраску своих растворов К. Шееле назвал манганат калия минеральным хамелеоном. Перманганаты — сильные окислители. Например, перманганат калия KMnO4 в кислой среде окисляет сернистый газ SO2 до сульфата: 2KMnO4 + 5SO2 +2H2O = K2SO4 + 2MnSO4 + 2H2SO4 Свойства перманганатов 2KMnO4 2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2 + 8H2O 2KMnO4 + 5KNO2 + 3H2SO4 = 2MnSO4 + 5KNO3 + K2SO4 + 3H2O 2KMnO4 + KNO2 + 2KOH = 2K2MnO4 + KNO3 + H2O 2KMnO4 + 3KNO2 + H2O = 2MnO2 + 3KNO3 + 2KOH
Окислительно-восстановительные реакции марганца (4), (6) и (7)
|

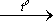 2MnO (Mn2O3 + Mn3O4)
2MnO (Mn2O3 + Mn3O4)













