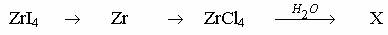Соединения с другими элементами. Карбиды и нитриды элементов подгруппы титана ЭN и ЭС (переменного состава) – кристаллические вещества
Карбиды и нитриды элементов подгруппы титана ЭN и ЭС (переменного состава) – кристаллические вещества, очень твердые, тугоплавкие (3000 – 40000С), хорошо проводят электрический ток, химически инертны. Аналогичными свойствами обладают силициды ЭSi2, бориды ЭВ, ЭВ2 также переменного состава. Нитриды ЭN можно получать не только прямым синтезом, но и высокотемпературным взаимодействием карбидов ЭС с азотом и водородом, а также взаимодействием оксидов ЭО2 с углем и азотом. Нитрид титана лишь при сильном нагревании реагирует с водяным паром и щелочами: 2TiN + 4H2O = 2TiO2 + 2NH3 + H2 2TiN + 4KOH + 2H2O = 2K2TiO3 + 2NH3 + H2 Карбиды ЭС получают высокотемпературным синтезом и взаимодействием ЭО2 с углеродом. При высокой температуре карбиды реакционноспособны, например: 2TiC + N2 + H2 = 2TiN + C2H2 Известен сульфид TiS, образующийся при восстановлении TiS2 и Ti2S3 водородом, а также при восстановлении TiCl4 сероводородом.
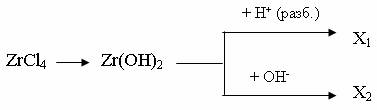
5.4. Гидроксиды, кислоты и их производные Гилроксиды Э (IV) – белые студенистые осадки переменного состава ЭО2∙хН2О. Они образуются при гидролизе тетрагалогенидов или при обработке их растворами щелочей. Гидроксид титана (IV) растворим в концентрированных щелочах; гидроксиды циркония (IV) и графния (IV) со щелочами практически не взаимодействуют. Вследствие амфотерности гидратированные диоксиды ЭО2∙хН2О иногда записывают в виде кислот, например: при х = 2 ― H4TiO4 − ортотитановая соли – ортотитанаты; при х = 1 ― H2TiO3 – метатитановая соли – титанаты. α- кислоты растворяются в минеральных кислотах; β- кислоты химически более инертны и растворяются только в HF и при нагревании в концентрированной H2SO4. При длительном хранении H4TiO4 переходит в H2TiO3. При сплавлении со щелочами H2TiO2 образует в зависимости от количества щелочи орто-, мета - или полититанаты. При взаимодействии оксидов или гидроксидов элементов группы IV B с кислотами образуются не средние соли, а соответствующие оксо – и гидроксопроизводные, например: Ti (OH)4 + 2HCl = TiOCl2 + 3H2O TiO2 + H2SO4 = TiOSO4 + H2O Соединения простого состава получают лишь в неводных растворах. Так, Ti(SO4)2 образуется при взаимодействии TiCl4 и SO3 в жидком хлориде сульфурила SO2Cl2 или сплавлением TiO2 с дисульфатом: TiCl4 + 4SO3 = Ti(SO4)2 + 2SO2Cl2 TiO2 + 2K2S2O7 = Ti (SO4)2 + 2K2SO4
Для всех рассматриваемых элементов очень характерно комплексообразование с галогенводородными кислотами и, особенно, с их солями. Наиболее характерны комплексы общей формулы Ме2[ЭГ6], где Ме – одновалентный металл. Они хорошо кристаллизируются и гораздо менее подвергаются гидролизу, чем исходные галогениды. ЭF4 + 2KF = K2[ЭF6] ЭO2 + 6HF = H2[ЭF6] + 2H2O Производные других анионных комплексов Э(IV) обычно образуются при сплавлении соответствующих соединений, например: ЭCl4 + 2KCl = K2ЭCl6 ЭO2 + 2KOH = K2ЭO3 + H2O TiO2 + CaCO3 = CaTiO3 + CO2 Состав оксотитанатов (IV), оксоцирконатов (IV) и оксогафнатов (IV) весьма разнообразен. Простейшие из них отвечают формулам МеЭО3 (Ме – одновалентный металл), Ме2ЭО4 (Ме – двухвалентный металл). Большинство оксосолей представляют собой смешанные оксиды. В воде они не растворяются, а производные щелочных металлов гидролизуются. Степень окисления +3 отчетливо проявляется лишь у титана. Производные Тi(III) получают восстановлением соединений Тi(IV), например: 2TiCl4 + H2 = 2TiCl3 + 2HCl Производные Тi(III) – восстановители. Они легко окисляются кислородом воздуха, диоксидом серы: 4TiCl3 + О2 + 2Н2О = 4TiОCl2 + 4HCl 4TiCl3 + 4HCl + SО2 + 6Н2О = 4 [Ti(H2О)2Cl4] + S На рис. 15 показана взаимосвязь между основными типами соединений на примере титана.
Рис. 15. Химические свойства титана и его соединений
5.5. Применение Ti, Zr, Hf широко применяются в качестве легирующих добавок, дегазантов, и раскислителей в производстве стали, латуни, бронзы. Высокая коррозионная и термическая устойчивость позволяет широко использовать эти металлы в производстве химической аппаратуры, турбореактивных двигателей, ракет и спутников. В высоковакуумной технике и радиоэлектронике Ti, Zr и Hf применяются как вещества, хорошо поглощающие газы. Zr и Hf используются в ядерной технике. Многие соединения элементов группы IV В обладают высокой твердостью и термостойкостью, на чем основано их применение.
6. КОНТРОЛЬНЫЕ ЗАДАНИЯ ПО ТЕМЕ “СВОЙСТВА ЭЛЕМЕНТОВ IV ГРУППЫ”
Вариант 1 1. Определите объем газообразного аммиака (298К, 1,04·105 Па) и массы угля и поташа, которые потребуются для получения 150 г цианида калия. 2. Составьте уравнение реакции получения особо чистого кремния восстановлением его тетрахлорида водородом. Определите температуру, при которой равновероятны оба направления реакции.
Вариант 2 1. Осуществите следующие превращения и назовите все соединения в них:
2. Закончите уравнения реакций, используемых для получения СО в лабораториях:
Вариант 3 1.Осуществите следующие превращения и назовите все соединения в них:
2.В 760 мл раствора содержится 10 г SnCl2. Вычислите молярность, нормальность и титр этого раствора.
Вариант 4 1.Сколько килограммов кремния и какой объем 32 % раствора NaOH (p= 1,35г/см3) потребуется для получения 15 м3 водорода (17 0С и 98,64 кПа)? 2.Осуществите следующие превращения и назовите все соединения в них:
Вариант 5 1.Раствор, содержащий 1,7 г Sn(NO3)2 в 250 г воды, кристаллизуется при − 0,13 0С. Определите значение изотонического коэффициента. Криоскопическая константа воды равна 1,86. 2.Какими свойствами обладают соединения титана (III)? Закончите уравнения реакций:
Вариант 6 1.Титан реагирует с концентрированной азотной кислотой подобно олову, а с растворами щелочей – подобно кремнию. Напишите уравнения реакций. 2.Определите состав соединения, полученного при взаимодействии 15,3 г Al2O3 с избытком углерода, если в результате реакции образовалось 10,08 л СО (н.у.) и твердое кристаллическое вещество массой 10,8 г.
Вариант 7 1.Какую массу циркония можно получить при термическом восстановлении 0,5 моль гексафтороцирконата (IV) калия магнием? 2.Напишите уравнения реакций, с помощью которых можно перевести тетрахлорид олова в дисульфид, из которого затем получить сульфид олова (II) и диоксид олова.
Вариант 8 1.Осуществите следующие превращения: Ti → TiCl3 → TiCl2 → Ti 2.Найдите химическую формулу газообразного силана SixHy, при сжигании 17,42 г которого образовалось 33,64 г SiO2. Плотность силана по аргону 1,558. Вариант 9 1.Осуществите следующие превращения и назовите все соединения в них:
2.Песок массой 200 г сплавили с гидроксидом кальция. Получили 320 г силиката кальция. Определите выход (масс. %) продукта по отношению к теоретически возможному.
Вариант 10 1.При полном взаимодействии гафния с избытком плавиковой кислоты собрано 5,04 л (н.у.) газа. Определите массу взятого для реакции гафния. 2.Сплав свинца с оловом растворили в избытке концентрированной HNO3. Получившийся осадок отфильтровали, высушили и прокалили. Каков состав осадка и какое вещество осталось в растворе?
Вариант 11 1.Составьте уравнения реакций:
2.Сколько диоксида гафния потребуется для реакции с расплавом NаOH, чтобы получилось 3,35 г ортогафната натрия?
Вариант 12 1.Сколько титана можно получить из 18 т минерала рутила в процессе магнийтермического восстановления хлорида титана, если исходное сырье содержит 90 % TiО2? Схема процесса:
2.Составьте уравнения реакций: а) Na2[Pb(OH)4] → б) PbSO4 + H2SO4 (конц.) → в) Pb(NO3)2 + KI →
Вариант 13 1.Составьте уравнения реакций с участием соединений углерода: а) СО2 + Na[Al(OH)4] → б) K2CO3 + AlCl3 + H2O → в) CaMg(NO3)2 + H2SO4 → 2.Осуществите следующие превращения и назовите все соединения титана в них: Ti → TiО2 → TiCl4 → TiС
Вариант 14 1.Какой объем 1 н. КОН необходимо добавлять к 0,2 л 4 % раствора SnCl2 (p=1,03 г/мл), чтобы последний полностью перевести в тетрагидроксостаннат? 2.Осуществите следующие превращения и назовите все соединения в них: TiCl4 → H2TiCl6 → TiOCl2 → Ti(OH)4
Вариант 15 1.Почему оксиды свинца Pb2O3 и Pb3O4 называют смешанными? Укажите степени окисления свинца в них. Составьте уравнения реакций взаимодействия Pb3O4 с концентрированным раствором щелочи. 2.Определите массу твердого вещества и объем газа (н.у.), полученных при сплавлении 100 г кварцевого песка с коксом в дуговой печи.
Вариант 16 1.Осуществите следующие превращения: Sn → Sn(OH)2 → Sn(NO3)2 → SnOHNO3 → Sn(NO3)2 → Sn 2.Какую массу циркония можно получить при термическом восстановлении 0,75 моль гексафторцирконата (IV) натрия металлическим натрием?
Вариант 17 1.Почему при приготовлении раствора SnCl2 воду подкисляют соляной кислотой? 2.Осуществите следующие превращения и назовите все соединения в них: ZrCl4 → Zr → ZrCl4 → H2[ZrCl6]
Вариант 18 1.Имея в распоряжении CaF2, SiO2, KOH и H2SO4 получите K2[SiF6]. 2.При полном взаимодействии титана с 29,2 мл концентрированного раствора NaOH (p = 1,438 г/мл) выделилось 1,68 л (н.у.) газа. Определите массу взятого для реакции титана и массовую долю раствора гидроксида натрия.
Вариант 19 1.Как отделить диоксид германия от диоксида свинца? 2.Осуществите следующие превращения и назовите все соединения титана в них: TiO2 → Ti(SO4)2 → TiOSO4 → H2TiO3
Вариант 20 1.При действии разбавленной HNO3 на Pb2О3 и Pb3О4 образуется в обоих случаях PbО2. Какие выводы можно сделать на основании продуктов реакций относительно строения Pb2О3 и Pb3О4? 2.Как можно получить сульфат оксотитана (IV) и хлорид цирконила?
|

 кислота,
кислота, кислота,
кислота,