Сорбція
Сорбцією називається процес поглинання певним тілом газів, пари або розчинених речовин з навколишнього середовища. Тіло, що поглинає речовину, називають сорбентом. Типові для сорбції процеси — абсорбція і адсорбція. Абсорбція — поглинання речовини, що супроводжується наступною її дифузією в глибину тіла і утворенням розчину. Поглинаючу речовину у цьому процесі називають абсорбентом. Нею звичайно є рідина. Адсорбція — це поглинання речовини поверхнею твердого поглинача — адсорбента. Якщо під час сорбції відбувається хімічна взаємодія між речовиною, що поглинається, і сорбентом, то такий процес називають хемосорбцією. Якщо ж поглинання супроводжується конденсацією пари в порах поглинача, таке явище називають молекулярною конденсацією. Процес сорбції зворотний. Виділення речовин під час зворотного процесу називають десорбцією. Сорбційні процеси дуже поширені у виробництві спирту, цукру, крохмалю, вина, ядерного палива. Абсорбцію застосовують у виробництві цукру (для очищання соку і сиропу), крохмалю (для одержання екстрагенту—розчину сірчистої кислоти), у консервному виробництві (для одержання розчинів, що забезпечують зберігання плодів і овочів), вина, спирту та інших продуктів. В усіх зазначених випадках абсорбентом є вода. У процесі абсорбції беруть участь дві фази: газоподібна — суміш компонента, який поглинається, з інертним носієм і рідка — абсорбент, що вибірково поглинає компонент, який переходить у рідкий розчин. До границі розділення фаз і від границі розділення вглиб абсорбента речовина, що поглинається, переноситься за допомогою конвективної дифузії, оскільки за виробничих умов обидві фази звичайно рухливі. Підвищення швидкості руху фаз збільшує швидкість перенесення речовини у кожній з фаз, внаслідок чого зростає загальна швидкість абсорбції. Швидкість абсорбції прямо пропорційна також площі контакту фаз і тиску, оскільки із зростанням тиску розчинність газів у рідині також зростає. Підвищення температури знижує швидкість абсорбції, оскільки погіршується розчинність газів у рідині. Рівновага в процесі абсорбції. Рушійною силою процесу абсорбції є різниця концентрацій речовин, що поглинається, у газі у і в розчині х. Процес припиниться, якщо концентрації зрівноважаться або коли парціальний тиск газу, шо поглинається, нал розчином досягне значення рівноважного Основним законом, що характеризує рівновагу в системі газ-рідина, є закон Генрі, за яким при незмінній температурі розчинність газу в рідині прямо пропорційна парціальному тиску р цього газу над розчином
Де х — концентрація в абсорбенті газу, що поглинається, кмолъ/кмолъ;
Парціальний тиск газу в суміші виражається залежністю
де у— концентрація в газовій суміші газу, що поглинається, кмолъ/кмолъ; Р — загальний тиск у суміші. З рівнянь (4.46) і (4.47) витікає
Де
Рис. 4.35. Крива абсорбційної рівноваги
Рис. 4.36. Схема протитечійного абчорбційного апарата У загальному випадку залежність між концентраціями у і х кривою рівноваги. Будують її за звичай за експериментальними даними. Матеріальний баланс абсорбції. У разі безперервного процесу в апараті, протитечія створює найбільшу середню рушійну силу (рис. 4.35). Концентрація в газі компонента, що поглинається, змінюється від Витрати інертного газу G і абсорбента L (кмоль/с) у процесі не змінюються. Якщо під час абсорбції не втрачається і речовина, яку поглинають, то кількість цієї речовини, що входить в абсорбер з газом
або
З рівняння (4.49) витікає
(4.49) Абсорцію здійснюють в насадочних та тарілчастих колонах. Тарілчасті колони дорожчі від насадочних, гідравлічний опір в них вищий, а ефективність розподілу вища. У більшості процесів всіх технологій має місце адсорбція з розчинів. Наприклад, у цукровому, лікеро-горілчаному, спиртовому, крохмале-патоковому виробництвах адсорбцію використовують для очищення і знебарвлювання продуктів або для очищання води, що надходить у виробництво, або вже використаної. У спиртовому і лікеро-горілчаному виробництвах адсорбцію застосовують для уловлювання пари і зменшення її витрат. Адсорбція розподіляється на фізичну, хемосорбцію, капілярну конденсацію. Загальним для всіх видів адсорбції лишається те, що її зумовлюють сили тяжіння між атомами і молекулами. Кількість речовини, поглинутої масовою або об'ємною одиницею поглинача залежить від природи його і речовини, яка поглинається, її концентрації в парогазовій суміші або розчині, що оточують адсорбент, температури і, в разі поглинання з газоподібного середовища, тиску. Процес адсорбції, як і будь-який інший масообмінний процес, перебігає в напрямі встановлення рівноваги між фазами. При незмінній температурі для даної пари адсорбент-адсорбтив за рівноважних умов має місце точно визначена залежність концен- трації адсорбтиву в адсорбенті ньому газі (розчині) С
Цю залежність, що виражає статику процесу, називають рівнянням ізотерми адсорбції. У найзагальнішому випадку рівноважна концентрація тим вища, чим більшими будуть молекулярна маса газу, що поглинається, тиск у парогазовій фазі і нижчою температура. У процесі адсорбції звичайно виділяється значна кількість теплоти, і, якщо її не відводити, температура шару адсорбента підвищиться, що негативно позначиться на його активності. Процес адсорбції зворотний. У виробничих умовах зворотний процес (десорбція) нерозривно зв'язаний з прямим процесом. Процесу десорбції активно сприяє підвищення температури і зниження тиску в середовищі, що оточує адсорбент. До адсорбентів промислових адсорберів належать: активоване вугілля (деревне, кам'яне, кісткове), силікагель, алюмогель, цеоліти, глини. Активоване вугілля одержують в результаті сухої перегонки відповідної сировини (деревини, тирси, кісточок з фруктів, кісток тварин відходів шкіри та інших матеріалів) з наступним вилученням смолистих речовин з шпар цих речовин. Питома поверхня активованого вугілля (600...700) гляді гранул розміром (1...7) мм або порошків з частинок розміром (25... 250) мкм. Силікагель (зневоджений гель кремнієвої кислоти) відрізняється від активованого вугілля однорідністю шпар рівномірним їх розподілом по об'єму частинки і здатністю витримувати високі температури. Питома поверхня його (300...750) Розміри зерен — (0,2...7) мм. Алюмогель (суміш нормального гідрату окису алюмінію з полігідратами) широко використовують для висушування газів, питома поверхня його (200...600) Глини (інфузорна земля, трепел) із меншою питомою поверхнею шпар, ніж в усіх згаданих раніше матеріалів — (200...400) Проте через низьку вартість і значне поширення в природі знаходять застосування в промисловості. Матеріальний баланс процесу адсорбції виражають рівнянням, аналогічним рівнянню (4.49) для процесу абсорбції, оскільки в обох процесах можна вважати незмінними кількості інертного газу G у кожній фазі, а також не рахуватися з втратами розподіленої в фазах речовини, що поглинається. Кінетика процесу адсорбції також має багато спільного з процесом екстракції в системі "тверде тіло — рідина". Процес складається з двох основних стадій: перенесення речовини всередині твердого тіла за законами молекулярної дифузії і масообміну на поверхні твердого тіла за законами конвективної дифузії. Процес адсорбції у промислових умовах може відбуватись періодично і безперервно. У першому випадку зернистий шар адсорбенту нерухомий, а газоподібна (рідка) фаза з речовиною, яку треба поглинати, фільтрується крізь шар. На початку процесу ад-сорбтив поглинається першими за рухом суцільного середовища шарами адсорбента. На певній висоті шару концентрація речовини, що поглинається, в газі впаде практично до нуля, потім фронт руху газу, на якому концентрація переходить від істотно більшої від нуля до нульової, буде повільно просуватися по висоті шару. Слідом за цим шаром, на певній відстані від нього, рухатиметься фронт суцільного середовища з концентрацією адсорбтива, що дорівнює початковій Со а весь шар адсорбента за цим фронтом оуде повністю насиченим і не поглинатиме більше адсорбтива. Щоб процес адсорбції відбувався безперервно, адсорбент повинен рухатись назустріч потоку газу (рідини). Це можливо у тому випадку, коли частинки адсорбента після їх повного насичення безперервно регенеруватимуться, охолоджуватимуться, а потім знову надходитимуть у робочу ділянку шару, де відбувається процес адсорбції.
|

 .
. (4.46)
(4.46)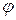 — коефіцієнт пропорційності (за Генрі).
— коефіцієнт пропорційності (за Генрі). (4.47)
(4.47) (4.48)
(4.48) — константа фазової рівноваги.
— константа фазової рівноваги.

 графічно виражається кривою лінією (4), яку називають
графічно виражається кривою лінією (4), яку називають а у рідкій фазі—від
а у рідкій фазі—від  кмоль/кмоль.
кмоль/кмоль. і абсорбентом
і абсорбентом дорівнюватиме кількості речовини, яка виходить з апарата з газом
дорівнюватиме кількості речовини, яка виходить з апарата з газом і абсорбентом
і абсорбентом 

 (4.49)
(4.49)
 від концентрації в навколиш-
від концентрації в навколиш-
 використовують його у ви-
використовують його у ви-


