Виробництво кислот та лугів
Із 22-х видів неорганічних кислот найчастіше використовують сірчану, азотну, соляну та фосфорну. Саме тому їх виробляють найбільше. Сірчана кислота (H Властивості сірчаної кислоти. Безводна сірчана кислота важка, безколірна, тягуча як олія рідина, змішується з водою і з SO 1850 кг/м У процесі нагрівання понад 200 °С розкладається:
Сірчана кислота має властивість забирати воду звідусіль, навіть з хімічних сполук. У сірчаній кислоті добре розчиняється SO Сірчайа кислота не димить, а концентрована не руйнує чорні метали. Зберігають сірчану кислоту на спеціальних складах у циліндричних сталевих резервуарах об'ємом до 1000 м Споживачі отримують башняну кислоту (74...75%), купоросну оливу (90.5...92,5%), акумуляторну кислоту (92...94%), олеум малої концентрації, який містить 18,5-20% вільного SO Використання сірчаної кислоти. Важко знайти галузь промисловості, де не використовують сірчану кислоту та її солі. Найбільшим споживачем сірчаної кислоти є підприємства, на яких виробляють мінеральні добрива (наприклад фосфорні), інші кислоти (концентровану азотну кислоту), солі (мідний купорос). На виробництво мінеральних добрив витрачається майже половина сірчаної кислоти. У металообробній промисловості сірчану кислоту використовують для очищення поверхонь металевих виробів перед нанесенням декоративно-захисних покрить (наприклад, лакове, цинкове, нікелеве, хромове покриття). її використовують у виробництві вибухових речовин, штучних і синтетичних волокон (наприклад, віскозне волокно, штучний шовк, капролактам). Велика кількість сірчаної кислоти витрачається на очищення нафтопродуктів. У харчовій промисловості сірчану кисло-зіюз 481 ту використовують для виробництва крохмалю, патоки та іншої продукції. Транспорт користується свинцевими сірчанокислими акумуляторами. За допомогою сірчаної кислоти регенерують йоніти, якими очищають воду на теплових електростанціях. Азотна кислота (H Властивості азотної кислоти. Безводна азотна кислота за нормальної температури є безбарвною рідиною. За температури 15 °С її густина становить 1520 кг/м
Азотна кислота є сильним окиснювачем. У процесі взаємодії з металами виділяється не водень, як має місце в разі дії соляної чи сірчаної кислот, а N0 і NO Концентровану азотну кислоту зберігають і перевозять у резервуарах і цистернах, виготовлених з алюмінію, та скляних бутлях. Поверхня алюмінію захищена від дії кислоти тонким корозієстійким шаром оксиду алюмінію. Оксиди азоту й азотна кислота належить до речовин із сильними отруйними властивостями; тому допустимий вміст оксидів азоту в повітрі не повинен перевищувати 0,1 мг/м Промисловість виробляє розведену азотну кислоту з вмістом (45...60)% HNO Використання азотної кислоти. Основним споживачем розведеної азотної кислоти є виробники мінеральних добрив, які містять азот. Це калієва, натрієва й амонійна селітри та комплексні мінеральні добрива. Концентровану азотну кислоту використовують для виробництва вибухових речовин, пластмас, барвників, нітролаків та інших речовин, Частина азотної кислоти йде на виробництво сірчаної кислоти нітрозним способом. Використовують азотну кислоту також як реактив у хімічних лабораторіях. Соляна кислота (НСl). Це безбарвна рідина з різким запахом., має густину 1180 кг/м Використання соляної кислоти. У промисловості соляну кислоту використовують у виробництві хлоридів металів, у гальва- нопластиці, у гідрометалургії для виробництва металів (платини, золота, срібла), у процесі паяння та лудіння металів, при бурінні нафтових свердловин, при гідролізі крохмалю, для очищення парових казанів від накипу, у процесі виробництва анілінових барвників, оцтової кислоти, активованого вугілля, дублення та фарбування шкіри, у побуті тощо. Лугами та содами називають розчинні у воді гідрооксиди амоніаку, лужних і лужноземельних металів, а також: вуглекислі солі лужних металів. У промисловості найбільше виробляють, а відповідно і використовують кальцитової, харчової та каустичної соди й амоніач-ної води. 1. Кальцинована сода (Na Промисловість виробляє технічну, фотографічну й оптичну кальциновану соду. Між собою вони відрізняються ступенем чистоти. Кальциновану соду використовують для виробництва оптичного та вакуумного скла, їдкого натру, мила, у текстильній, це-Ілюлозно-паперовій, лакофарбовій, шкіряній промисловостях, а також для побутових потреб. 2. Каустична сода (NaOH). її ще називають гідрооксидом натрію або їдким натром. Це біла кристалітна речовина з температурою плавлення 321 °С і кипіння 1378 °С. На повітрі каустична сода швидко поглинає вологу та вуглекислий газ. Тому для її зберігання та перевезення необхідна вологонепроникна тара. Виробляють каустичну соду електролізом водного розчину хлориду натрію. Каустичну соду використовують у виробництві штучних волокон, паперу, мила, синтетичних барвників, у текстильній промисловості, металургії для виробництва натрію, для очищення нафтопродуктів (бензину, гасу) тощо. 3. Харчова сода (NaHCO Очищений гідрокарбонат натрію використовують у харчовій промисловості, медицині, вогнегасниках, для побутових потреб тощо. Гідрокарбонати натрію, які використовують у харчовій промисловості та медицині, не повинні містити в собі солей амоніаку, важких металів і арсену.
|

 SO
SO  ) Серед мінеральних кислот, які виробляє хімічна промисловість, сірчана кислота за обсягом виробництва й використання посідає перше місце. Вона належить до найсильніших і найдешевших кислот.
) Серед мінеральних кислот, які виробляє хімічна промисловість, сірчана кислота за обсягом виробництва й використання посідає перше місце. Вона належить до найсильніших і найдешевших кислот. у будь-якому співвідношенні, за температури 0 °С має густину
у будь-якому співвідношенні, за температури 0 °С має густину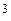 .
.




