Генная инженерия и проблемы безопасности
ВКонтакте: http://vk.com/tigrenok_tgu; http://vk.com/school_tgu На сайте ТюмГУ:www.utmn.ru; www.dar.utmn.ru Трансгенные продукты Генная инженерия и проблемы безопасности
Это молодая, но уже окрепшая область научных изысканий создала мощный фундамент развития отраслей народного хозяйства.
Первоначально к генетической инженерии относили работы только с отдельными молекулами ДНК или генами. В настоящее время понятие «гене- тическая инженерия» расширено и в ней выделено два раздела: генная инже- нерия и геномная инженерия. Генная инженерия (или трансгеноз) методами in vivo и in vitro решает задачи введения в геном реципиентной клетки одного или нескольких чуже- родных генов либо создания в геноме новых типов регуляторных связей. При этом видовая принадлежность реципиентных организмов не меняется, но по- являются не свойственные им признаки. Геномная инженерия связана со всей генетической программой орга- низма, и перед ней стоят задачи более глубокого вмешательства в геном, вплоть до создания новых видов организмов. Остановимся лишь на общих подходах в получении и применении ген- но-модифицированных объектов в технологии пищевых продуктов.
Общие подходы. Генная инженерия в самом широком смысле слова - это рекомбинация in vitro, и суть ее заключается в конструировании организ- мов с заданными свойствами путем целенаправленных операций над молеку- лами или структурами, несущими генетическую информацию. При этом ви- довая принадлежность организмов не меняется, но появляются не свойствен- ные им признаки. Генная инженерия возникла не вдруг, а имеет богатую предысторию. Своими корнями она уходит в период развития методов классической гене- тики (1900-1940). В этот период с помощью количественного анализа, вве- денного Г. Менделем, и работ по изучению законов поведения наследствен- ных признаков удалось сформулировать основное понятие об единице на- следственности - гене. Однако материальная природа генов оставалась до се- редины столетия неизвестной, а генетические методы в этот период носили чисто формальный характер. С введением микроорганизмов в практику генетики (начало 40-х годов XX в.) увеличилась разрешающая способность генетического анализа и поя- вилась возможность взглянуть на наследственность и изменчивость с хими- ческой точки зрения. В этот период были заложены основы для возникновения генной инже- нерии как науки, было показано, что материальной основой наследственно- сти и изменчивости являются молекулы ДНК, постулирована двухцепочеч- ная структура ДНК, доказано, что наследственная информация, содержащая- ся в ДНК, кодируется последовательностью пар оснований. Открыта и - РНК и доказано, что она содержит информацию, определяющую порядок распо- ложения аминокислотных остатков в белках, установлено, что ген не только кодирует структуру определенного продукта, но и регулирует процесс его синтеза. Полностью расшифрован генетический код и обнаружены элементы, управляющие действием генов, промоторы, операторы, терминаторы транс- крипции и трансляции. Энзимологи обнаружили разнообразные ферменты матричного синтеза.
В конце 60-70-х годов XX в. получили распространение исследования нуклеиновых кислот методами in vitro, позволившие синтезировать, выделять и перемещать гены. Так, в 1969 г. Дж. Беквиту с сотрудниками удалось выде- лить лактозный оперон Е. coli в чистом виде. В эти же годы Г. Корана впер- вые химическим путем синтезировал ген аланиновой т- РНК дрожжей. В свою очередь, значительных успехов достигли эмбриологи при работе с за- родышевыми клетками животных. Стало понятным, что если есть эмбриональные клетки и «чистые» ге- ны, то появляется возможность заменить определенные дефектные гены пол- ноценными, т. е. осуществить генную терапию. На рубеже 70-х годов были созданы условия для перехода от анализа генов к их синтезу, от изучения ге- нетической природы организмов к их переделке. Вскоре ученые пришли к выводу, что наиболее реальной является задача конструирования бактерий с не свойственными им признаками, в том числе высокоэффективных штаммов промышленных микроорганизмов. В 1973 г. С. Коэном было обнаружено, что фрагменты ДНК с «липкими концами» можно получить обработкой ДНК рестрикционными эндонуклеа- зами. В плазмиду ДНК были встроены фрагменты чужеродной ДНК, в ре- зультате чего получены химерные плазмиды. В результате проведенных ис- следований было доказано, что их можно ввести обратно в клетки бактерий в функционально активном состоянии, т. е. клонировать. В последующие годы была продемонстрирована принципиальная возможность клонирования фрагментов ДНК в бактериях любого гена, было сформулировано представ- ление о векторных молекулах, разработаны новые методы объединения фрагментов ДНК in vitro, выявлены основные закономерности экспрессии генов в чужеродном окружении. Генная инженерия позволяет решать важнейшие для человека задачи: • повышать эффективность отдельных генов у продуцентов, изменив или интенсифицировав их функции, что улучшает биосинтетическую дея- тельность штамма, например без введения новой генетической инфор- мации, а модифицируя его собственную; • выделять конкретный ген, отвечающий за синтез того или иного белка, и получать мутации; • получать мутации промоторов, от которых зависит активность генов; вводить усилители активности промоторов (энхансеры); • создавать штаммы микроорганизмов, утилизирующие отходы различных производств; продукты переработки нефти, биологически активные ве- щества (ксенобионты), создаваемые человеком; другие загрязнители ок- ружающей среды, стимулируя тем самым развитие безотходных техно- логий; • улучшать свойства штаммов, внося в неспаривающиеся микроорганизмы половые плазмиды, обеспечивающие спаривание и обмен генетической информацией;
• вносить в клетки микробов гены других групп организмов и получать продукты этих генов; • создавать новые белки, конструируя новые гены путем их синтеза или клонирования. Генная инженерия достигла существенных результатов при решении прикладных задач. Например, в лаборатории Г. Бойера (США, 1977 г.) впер- вые удалось заставить бактериальную клетку производить животный гормон - соматостатин, выход которого составил 10 тыс. молекул на клетку. Из 100 г биомассы бактерий, выращенных в 8 дм3 среды, удалось выделить 5 мг сома- тостатина - столько же, сколько выделяют из 100 овечьих мозгов. Так, в США была создана первая генно-инженерная компания (Genentech) для про- изводства медицинских препаратов с использованием методов рекомбинант- ных ДНК, а с 1980 г. начато строительство первого предприятия (в г. Стренг- несе) для промышленного производства генно-инженерного инсулина. К настоящему моменту в клетках Escherichia coli клонировано большое многообразие генов различных организмов, в том числе генов человека. Для многих из них осуществлена экспрессия. Эта возможность использована для получения видоспецифических продуктов (инсулина, интерферонов, гормона роста), а также белков - антигенов тех вирусов, которые слабо размножаются или не размножаются совсем в клеточных культурах (вирус гепатита В, гриппа, ящура, SV40). Генная инженерия и возникшее на ее основе новое направление био- технологии, несомненно, стали мощным средством воздействия человека на окружающую среду и самого себя. Открытие ферментов - рестриктаз, «разрезающих» молекулу ДНК тол- щиной в одну миллионную миллиметра на маленькие кусочки, словно нож- ницы, было сделано швейцарским биохимиком Вернером Арбером в 60-х го- дах XX в. Спустя десятилетие американцы Герберт и Бойер установили спо- собность рестриктаз разрезать ДНК только в определенных местах. В этот же период стали известны ферменты лигазы, склеивающие «разрезанные» уча- стки. Вооружившись багажом знаний своих предшественников, С. Коэн и Г. Бойер в 1973 г. приступили к первым опытам с рекомбинантной ДНК. В 1978 г. был получен первый результат: «сконструированный» в пробирке из фрагментов ДНК ген инсулина человека был встроен в разрезанные кольца плазмид бактерий, после чего плазмиды вернули обратно в бактерию, кото- рая начала интенсивно синтезировать инсулин человека.
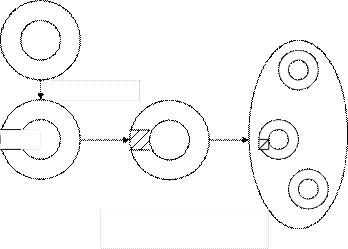
Получение рекомбинантных ДНК. Генетическая инженерия сводится по существу к процессу получения рекомбинантных ДНК, содержащих, помимо набора природных генов, присущего «хозяйской» ДНК, «чужой» ген или гены, взятые из другой ДНК. Метод получения рекомбинантных ДНК состоит из нескольких этапов: а) выделение ДНК из клеток организма (получение генетического ма- териала);
б) получение гибридных (рекомбинантных) молекул ДНК путем встройки в исходную ДНК «чужого» гена, выделенного из другой ДНК или полученного химическим синтезом; в) введение рекомбинантной ДНК в живую клетку (бактерий, дрожжей, растительных или животных клеток, клеток человека); г) создание условий для проявления (экспрессии) генов рекомбинант- ной ДНК в живой клетке и секреции нового продуцента, кодируемого «чу- жим» геном. На рис. 2.1 показана схема получения рекомбинантных ДНК и реком- бинантных штаммов микробов. Из рис. 2.1 видно, что клонированный (т.е. выделенный из ДНК клетки) природный или химически синтезированный ген целевого продукта (например, инсулина, интерферона) встраивается в ДНК (на- пример, в плазмиду какой-либо бактерии или в ДНК вируса) после расщепле- ния ДНК с помощью ферментов рестриктаз. Вставленный в расщепленную ДНК ген «сшивается» с этой ДНК с помощью ферментов лигаз. Полученная реком- бинантная ДНК бактерий или вируса затем вводится в эту же микробную клетку или вирусную частицу, из которой была взята, и таким образом получают ре- комбинантный штамм бактерий или вирусов.
ДНК 2 плазмида
ДНК 1
Фаг
Вирус
ДНК
Рестриктаза Введение в клетку
+
Рестриктаза
Лигаза
Клонированный или химически синтезированный целевой ген Расщепленная ДНК 2 (вектор) Рекомбинантная ДНК (плазмида с целевым геном)
Рис. 2.1. Получение рекомбинантных ДНК и рекомбинантных штаммов микроорганизмов (генетическая инженерия)
При культивировании рекомбинантного штамма в процессе роста и раз- множения этот штамм синтезирует не свойственный ему продукт, кодируемый встроенным чужеродным геном (например, инсулин, интерферон). На этом принципе в настоящее время получены сотни рекомбинантных штаммов бакте- рий, дрожжей, вирусов, способных продуцировать разнообразные биологически активные вещества: антигены, антитела, ферменты, гормоны, иммуномодулято-
ры и др. Технология получения биологически активных веществ, основанная на применении рекомбинантных штаммов, по существу не отличается от типовой биотехнологической схемы. Она сводится к культивированию рекомбинантного штамма, выделению синтезируемого штаммом целевого продукта, его очистке и концентрированию и созданию конечной формы препарата. В настоящее время уже разработаны сотни медицинских препаратов, полученных на основе генетической инженерии. Многие из них внедрены в практику и применяются в медицине. Это гормоны (инсулин и гормон роста человека), антикоагулянты и тромболитики (тканевой активатор плазминогена, факторы VIII и IX), вакцины («дрожжевая» вакцина против гепатита В), им- муномодуляторы (интерфероны а, р и у, интерлейкины 1, 2 и др., фактор нек- роза опухолей, пептиды тимуса, миелопептиды), ферменты (уреаза), ангиоге- нин, диагностические препараты (на ВИЧ-инфекцию, вирусные гепатиты и др.), моноклопальные антитела, колониестимулирующие факторы (макрофагальный, гранулоцитарный и др.), а также многие биологически активные пептиды. Применение генетической инженерии в биотехнологии оправдано в тех случаях, когда: а) нужное вещество невозможно получить никаким другим спо- собом; б) если технология эффективнее и экономичнее традиционной или в) если она более безопасна для человека и окружающей среды. Например, антиге- ны для создания вакцин против некультивируемых микроорганизмов (плазмо- дий малярии, возбудитель сифилиса) можно получить только генно-инженерным способом. Генно-инженерный интерферон превосходит по активности интер- ферон, полученный из лейкоцитов крови, и значительно дешевле последнего. Приготовление препаратов из антигенов возбудителей особо опасных инфекций (чума, холера) можно заменить биосинтезом их рекомбинантными штаммами непатогенных бактерий.
Практические аспекты генной инженерии. Цель генной инженерии -
Развитие генной инженерии создало принци- пиально новую основу для конструирования после- довательности ДНК, необходимой для практической деятельности человека. Рис. 2.2. Опухоли на стеблях табака
Для внедрения чужеродной ДНК в геном расте- ний существуют следующие методы: • агробактериальная трансформация; • электропорация; • микроинъекция ДНК; • агроинфильтрация; • бомбардировка микрочастицами; • использование вирусных векторов. Весьма широко применяется метод, основан- ный на способности агробактерии Agrobacterium turnefaciens (пищевая бактерия, вызывающая опухо- ли) встраивать участки своей ДНК в растения, после чего пораженные участки начинают очень быстро
Рис. 2.3. Опухоли растений, вызваемые агробактериями делиться, и образуется опухоль (рис. 2.2, 2.3). Сначала ученые получили штамм этой бактерии, не вызывающей опухолей, но не лишенной возможно- сти вносить свою ДНК в клетку. В дальнейшем нужный ген сначала клони- ровали в агробактерии, а затем заражали уже этой бактерией растение. В ре- зультате инфицированные клетки растения приобретали нужные свойства, а вырастить целое растение из одной его клетки сейчас не проблема. Используя успехи в области экспериментальной эмбриологии, был раз- работан метод введения искусственно созданных генов в ядра яйцеклеток или сперматозоидов. В результате появилась возможность получения транс- генных животных, т. е. животных, несущих в своем геноме чужеродные ге- ны. Эксперименты по клонированию животных впервые осуществили в 50-х годах XX в. американские эмбриологи Р. Бриге и Т. Кинг, которые пересади- ли в яйцеклетку лягушки ядро зрелой клетки, предварительно удалив из яй- цеклетки собственное ядро. В России подобные опыты несколько ранее про- водил Г. Лопашев, но результаты их не были опубликованы, так как генетика считалась в то время в СССР лженаукой. Термин «клонирование» (от греч. «klon» - ветвь, побег) означает точное воспроизведение живого объекта в одной или нескольких копиях, притом это может быть: • получение идентичных копий фрагментов ДНК (клонирование фрагмен- тов ДНК); • получение группы клеток с одинаковым генотипом (клонирование кле- ток взрослого организма). Исследователи работают над созданием растений, устойчивых к раз- личного рода заболеваниям благодаря введенному в их генотип специфиче- скому гену; стремятся избавить человечество от неизлечимых генетических болезней. Из бактерий Escherichia coli получают соматотропин - гормон роста че- ловека. До 1980 г. его получали из гипофизов, выделенных из трупов. Сома- тотропин представляет собой полипептидную цепь, состоящую из 191 ами-
нокислоты. Недостаток гормона роста в организме приводит к карликовости. Полученный из клеток бактерии соматотропин свободен от вирусных загряз- нений, чист биохимически, экономически доступен, и его можно получать в любых количествах. Способы модификации ДНК и перенос ее из одного организма в другой позволили осуществить биосинтез инсулина человека в клетках Escherichia coli, получить интерферон (против вирусной инфекции, опухолей), создать новые виды вакцин (против гепатита, сифилиса, ящура животных). Голландские ученые заявили, что они могут создать искусственное мя- со в лабораторных условиях. При этом не придется убивать ни одного живо- го существа. Ученые планируют использовать тот же метод, которым поль- зуются при производстве искусственной кожи. По их мнению, можно полу- чить мясо массой 50 кг в больших контейнерах. Мясо можно производить, используя коллагены и клетки мышечной ткани, полученные от доноров (животных). При этом последним не будет причинен какой-либо вред. Мышечная ткань затем будет выращиваться на коллагене. Вместимость контейнеров при этом должна быть более 5000 л, где мя- со будет расти в специальном растворе, который состоит из 62 ингредиентов, включая 20 аминокислот, 12 витаминов и разнообразные ферменты. Конеч- ный продукт будет иметь структуру и вкус постного мяса, но, самое главное, по словам исследователей, не будут страдать животные. Голландские ученые заявляют, что свинина, говядина и мясо цыпленка могут быть получены ис- кусственным путем, для любителей мяса экзотических животных без про- блем можно вырастить мясо кенгуру, кита или различных моллюсков.
|


 Целевой ген
Целевой ген




