Вправи та задачі з розв’язками
1. Мотивуйте доцільність використання в якості протектора цинкової пластини, якщо корпус пароплаву виготовлений зі сталі? Розв’язок: Основним компонентом сталі є залізо (98%). Е º(Fe2+/Feº) = −0,44 B (пасивніший метал); Е º(Zn2+/Znº) = −0,76 B (активніший метал). K(+), Fe А(−), Zn Fe + ē ¹ Zn − 2ē = Zn2+ 2H2O + 2ē = H2 + 2OH1− Цинкова пластина буде руйнуватися (кородувати), на поверхні сталевого корпусу відбуватиметься незначне виділення водню і утворення слабко лужного середовища.
2. Залізна деталь занурена в розчин нікол(ІІ) нітрату Ni(NO3)2. На скільки збільшиться маса деталі, на яку наноситься електролітичним способом нікелеве покриття, якщо сила струму 5 А, тривалість 20 хв, а вихід за струмом становить 72%? Розв’язок:
Ni(NO3)2 Ni2+ + 2NO31− K(−) A(+) Ni2+, H2O NO31−, H2O Ni2+ + 2ē = Niº 2H2О − 4ē = 4Н1+ О2 На катоді виділяється металічний нікель, на аноді − кисень та створюється слабкокисле середовище. 1. Яка маса нікелю виділиться теоретично (за законом Фарадея)? m (Ni) = m (Ni) = 2. Який вихід нікелю за струмом (практичний вихід)?
m практ.(Ni) = η × m теор.(Ni), m практ.(Ni) = 0,72 × 1,82 = 1,31 (г). Відповідь: m практ.(Ni) = 1,31 г
ВПРАВИ І ЗАДАЧІ ДЛЯ САМОСТІЙНОГО РОЗВ’ЯЗУВАННЯ
1. Обчисліть відносні молекулярні маси речовин: 1) К2SO3; 2) H3PO4; 3) CаSO4; 4) К2SO3; 5) HPO3; 6) CаСO3; 7) Zn(NO3)2; 8) Na3PO4; 9) Fe(OH)3; 10) N2O5; 11) P2O3; 12) HC1O4; 13) Mg3N2; 14) Mn2O7. 2. Обчисліть молярні маси речовин: 1) Cr(OH)3; 2) N2O3; 3) Na2CO3×10H2O; 4) MgSO4×7H2O; 5) K2Cr2O7; 6) ZnSO4×7H2O; 7) CaSO4×2H2O; 8) KMnO4; 9) BaC12×2H2O; 10) KOH×2H2O; 11) KC1O3; 12) 2CaSO4×H2O; 13) FeSO4×7H2O; 14) K2MnO4. 3. Обчисліть молярні маси еквівалентів речовин у обмінних реакціях: 1) H2CO3, 2) Fe2(SO4)3, 3) Ca(NO3)2; 4) Zn(OH)2; 5) K2CO3, 6) Cu(NO3)2; 7) Mg(OH)2; 8) A12(SO4)3; 9) Fe(OH)3; 10) H3PO4; 11) H2SO4; 12) Ba(OH)2; 13) H2S; 14) Ca(OH)2. 4. Який об’єм газу утворився при взаємодії 9,75 г цинку з хлоридною кислотою, взятої у надлишку за температури 200 С та тиску 100,5 кПа. В .: V(Н2) = 3,63 дм³; 5. Яка відносна густина озону за гелієм? В .: D(О3/Hе)=12,0 6. Який об’єм газу утворився при взаємодії 5,6 г заліза з сульфатною кислотою, взятої у надлишку за температури 170 С і тиск 101,0 кПа. В .: V(Н2) = 2,39 дм³; 7. Яка відносна густина карбон(ІV) оксиду за повітрям? В .: D(СO2/пов.)=1,517 8. Який об’єм газу утворився при взаємодії 2,4 г магнію з хлоридною кислотою, взятої у надлишку за температури 170 С і тиску 100,5 кПа. В .: V(Н2) = 2,4 дм³; 9. Яку кількість речовини становлять 0,224 дм3 газу хлороводню? В .: п(НС1)=0,01 моль 10. Який об’єм газу утворився при взаємодії 2,7 г алюмінію з сульфатною кислотою, взятої у надлишку за температури 200 С та тиску 100,5 кПа? В .: V(Н2) = 3,63 дм³; 11. Яку кількість речовини становлять 5,18 г манґан нітрату? В .: п(Mn(NO3)2)=0,035 моль 12. Який об’єм газу утворився при взаємодії 5,9 г нікелю з хлоридною кислотою, взятої у надлишку за температури 170 С і тиск 101,6 кПа? В .: V(Н2) = 2,37 дм³; 13. У посудині об’ємом 5,6 дм3 міститься азот (н.у.). Розраху-вати кількість речовини, число молекул та їх масу у посудині. В .: п(N2)=0,25 моль; 1,505·1023 молекул; m(N2)=7 г 14. У посудині об’ємом 2,8 дм3 міститься дигідроген сульфід (н.у.). Розрахувати кількість речовини, число молекул та їх масу в посудині. В .: п(Н2S)=0,125 моль; 7,525·1022 молекул; m(Н2S)=4,25 г 15. Який об’єм (н.у.) займає газ хлороводень масою 29,3 г? В.: V(НС1) = 8,96 дм3 16. Яка маса газу карбон(ІV) оксиду взятого об’ємом 33,6 дм3 за нормальних умов? В.: m(СO2) = 66 г 17. Яка молярна маса газуватої речовини, якщо її маса 6,8 г займає об’єм 4,48 дм3 за нормальних умов? В.: M(газ.р.)=34 г/моль 18. Яка маса природного газу метану (СН4), взятого об’ємом 0,5 дм3, за температури 27°С та тиску 102 кПа? В .: m(СН4)=0,33 г 19. Складіть електронні та електронно-графічні формули атомів: 1) 20Cа та 35Br; 2) 19К та 25Mn; 3) 37Rb та 21Sc; 4) 12Mg та 30Zn. 20. Вкажіть можливі значення побічного та магнітного кван-тових чисел для електронів, що знаходяться на 3 енер-гетичному рівні. 21. Якому правилу Клечковського відповідають запропоновані варіанти енергетично вигідного порядку розміщення електронів: 1) 4 p 5 s,6 s 5 d, 2)4 s 4 p,5 f 4 d, 3) 4 s 3 d,5 s 5 p, 4) 3 d 4 p, 3 p 4 s. 22. Вкажіть елементи та підгрупу, в якій вони знаходяться, якщо валентні електрони у атомів розміщенні відповідно на таких підрівнях: 1) 4 s 24 p 5 та 4 s 23 d 5 , 2) 5 s 25 p 6 тa 3 d 104 s 1, 3) 3 d 84 s 2 тa 3 s 23 p 1, 4) 3 d 64 s 2 та 3 s 23 p 4. 23. Вкажіть тип аналогії у таких пар атомів: 1) В–А1 та Р–V, 2) Мn–Тс та S−Мо. 24. В якісному плані порівняйте енергетичні характеристики атомів (потенціал йонізації, споріднення до електрону) та радіуси атомів: 1) Cа–Mg і S–Se, 2) Li– K і Be–B, 3) Se–Te і N–C. 25. Знайдіть помилку, допущену при написанні електронної фор-мули розподілу електронів в атомі; відповідь аргументуйте. 1) 13А1 1s2 2s2 2р3 3s2 3р4; 2) 16S 1s2 2s2 2р6 3s1 3р5; 3) 19К 1s2 2s2 2р6 3s1 3р6 4s1; 4) 23V 1s2 2s2 2р6 3s2 3р53d2 4s2 5) 21Sc 1s2 2s2 2р6 3s2 3р6 4s3; 6) 15P 1s2 2s2 2р3 3s1 3р4; 7) 34Sе 1s2 2s2 2р6 3s2 3р6 4s1 4р5; 8) 11Nа 1s2 2s2 2р5 3s2; 9) 35Br 1s2 2s2 2р8 3s2 3р8 3d10 4s2; 10) 12Mg 1s2 2s2 2р7 3s1 ; 11) 8O 1s2 2s2 2р3 3s1 ; 12) 14Si 1s2 2s2 2р6 3s1 3р4. 26. Користуючись періодичною таблицею, вкажіть 3 приклади катіонів, які мають таку електронну формулу: 1) [Не], 2) [10Nе].
27. Користуючись періодичною таблицею, вкажіть 3 приклади аніонів хімічних елементів, які мають таку електронну формулу: 1) [10Nе], 2) [18Аr], 2) [36Кr]. 28. Пропишіть електронну та електронно-графічну формули вказаних йонів. 1) Вr5+ та Fe3+; 2) C11– та Co2+; 3) А13+ та S4+; 4) I1+ та Cd3+; 5) C4+ та Zn2+ 6) Ni2+ та Вr5+; 7) N3– та Cu2+; 8) I1– та Cr2+; 9) C17+ та Sr2+ 10) Br1+ та Ca2+. 29. Що спільного у будові атомів з порядковими номерами: 1) 17 та 25, 2) 19 та 29, 3) 23 та 33, 4) 7 та 83, 5) 42 та 74, 6) 35 та 53? 30. У якого з елементів радіус атома найбільший, а у якого − найменший? Відповідь аргументуйте. 1)Ca, A1, P, 2) Na, Br, As, 3) С, Si, C1, 4) К, Mg, Ar, 5) C, N, O, 6) S, С1, Mn. 31. Вкажіть формули оксидів та гідроксидів таких елементів як Кадмій та Сульфур (вища валентність). Назвіть сполуки та вкажіть їхню природу. Якими хімічними властивостями вони володіють? Запишіть відповідні рівняння реакцій? 32. Вкажіть формули оксидів та гідроксидів таких елементів як Нікол (валентність ІІІ) та Бром (валентність V). Назвіть спо-луки та вкажіть їхню природу. Якими хімічними власти-востями вони володіють? Запишіть відповідні рівняння реакцій? 33. Вкажіть формули оксидів та гідроксидів таких елементів як Нікол (валентність ІІ) та Іод (вища валентність). Назвіть сполуки та вкажіть їхню природу. Якими хімічними властивостями вони володіють? Запишіть відповідні рівняння реакцій? 34. Вкажіть формули оксидів та гідроксидів таких елементів як Ферум (валентність ІІІ) та Хлор (валентність V). Назвіть сполуки та вкажіть їхню природу. Якими хімічними властивостями вони володіють? Запишіть відповідні рівняння реакцій? 35. Напишіть формули таких сполук: купрум сульфат(ІV), аргентум карбонат, нікол(ІІ) гідроксид, хлороводень, манган сульфат, дигідроген селенат. Вкажіть класи неорганічних сполук, до яких вони відносяться. Яка з перерахованих речовин вступає в реакцію гідролізу? Пропишіть рівняння процесу. 36. Напишіть формули таких сполук: кальцій карбонат, барій нітрат, ферум(ІІІ) гідроксид, натрій сульфід, цинк фосфат, калій сульфат. Вкажіть класи неорганічних сполук, до яких вони відносяться. Яка з перерахованих речовин вступає в реакцію гідролізу? Пропишіть рівняння процесу. 37. Напишіть формули таких сполук: аргентум сульфат, барій гідроксид, ферум(ІІІ) оксид, цинк карбонат, калій суль-фат(ІV). Вкажіть класи неорганічних сполук, до яких вони відносяться. Яка з перерахованих речовин вступає в реакцію гідролізу? Пропишіть рівняння процесу. 38. Вкажіть формули оксидів та гідроксидів таких елементів як Кобальт (валентність ІІ) та Бром (валентність V). Назвіть сполуки та вкажіть їхню природу. 39. Вкажіть формули оксидів та гідроксидів таких елементів як Магній та Сульфур (вища валентність). Назвіть сполуки та вкажіть їхню природу. 40. Вкажіть формули оксидів та гідроксидів таких елементів як Цинк та Хлор (вища валентність). Назвіть сполуки та вкажіть їхню природу. 41. Напишіть формули таких сполук: барій карбонат, цинк нітрат, кобальт(ІІІ) оксид, ферум(ІІ) сульфід, алюміній гідроксид, кальцій сульфат. Вкажіть класи неорганічних сполук, до яких вони відносяться. Яка з перерахованих речовин вступає в реакцію гідролізу? Пропишіть рівняння процесу. 42. Напишіть формули таких сполук: калій сульфат(ІV), кальцій оксид, кадмій фосфат, цинк силікат, плюмбум(ІІ) гідроксид. Вкажіть класи неорганічних сполук, до яких вони відносяться. Яка з перерахованих речовин вступає в реакцію гідролізу? Пропишіть рівняння процесу. 43. Напишіть формули таких сполук: кальцій нітрат, купрум(ІІ) бромід, нікол(ІІІ) оксид, натрій сульфат, барій хромат; вкажіть класи неорганічних сполук, до яких вони відносяться. Яка з перерахованих речовин вступає в реакцію гідролізу? Пропишіть рівняння процесу. 44. Напишіть формули таких сполук: цинк силікат, барій сульфат(ІV), купрум(ІІ) гідроксид, амоніак, магній нітрат, нітроген(ІV) оксид. Вкажіть класи неорганічних сполук, до яких вони відносяться. Яка з перерахованих речовин вступає в реакцію гідролізу? Пропишіть рівняння процесу. 45. Вкажіть тип зв’язку, що виникає в речовинах: HF, магналію (сплав А1 та Мg), Nа2S, Н2О. Коротко аргументуйте. 46. Складіть валентні схеми молекул сполук СО2, С2Н4, Н2S, користуючись електронно-графічним способом зображення електронної будови атомів. 47. Користуючись електронно-графічним способом зображен-ня, покажіть утворення гідроксоній-іону (Н3О1+) з молекули води (Н2О). 48. Користуючись таблицею електронегативності, визначте, вид зв’язку в сполуках, що наведені нижче. Назвіть ці сполуки та напишіть електроно-графічні формули їх. 1) НІ, О2, РС15, FeS2, NO2; 2) NаВr, HgC12, A12О3, Вr2; SO3; 3) НС1, КВr, I2, FeО, Р2О3; 4) RbBr, O3, HAt, SO3, CaH2; 5) СаВr2, СdS, Fe2О3, N2, C2H2; 6) Cr2O3; PC13; F2; CuS; K2O.
49. Користуючись таблицею електронегативності, розмістити сполуки, формули яких наведені нижче, у послідовний ряд збільшення полярності зв’язку у сполуках: 1) Br2; Co2O3; NH3; NaC1; H2S; Ni2O3; 2) CdC12; H2; CaC2; PH3; SiO2; CoBr2; 3) PCl5, CoBr3, ZnS, NiI2, F2; CuS; 4) N2O5; A1Br3; AgC1, О2, PbO; CaI2.; 5) SnO; C12; CdC12; Co2S3; NiBr3; N2О5. 50. Взаємодія водню з хлором зображується такою схемою рів-няння реакції: Н2(г.) + С12(г.) ® НС1(г.). При взаємодії хлору об’ємом 2 дм3 (н.у.) виділяється 16,4 кДж теплоти. Яка теплота утворення гідроґен хлориду? Напишіть термохі-мічне рівняння. В.: Qут В. (НС1)=91,8 кДж/моль 51. Горіння сірководню зображується такою схемою рівняння реакції: Н2S(г.) + О2(г.) ® Н2О(г.) + SО2(г.). Який тепловий ефект реакції, якщо теплоти утворення (кДж/моль) сірководню, пари води та сульфур(ІV) оксиду відповідно дорівнюють 20,9, 241,6, 289,7? Напишіть термохімічне рівняння. В.: Qр.=510,4 кДж 52. Кальцій оксид взаємодіє з водою за такою схемою рівняння реакції: СаО(к.) + Н2О(р.) ® Са(ОН)2(к.) Яка кількість теплоти виділиться при взаємодії кальцій оксиду масою 175 г з водою, якщо теплоти утворення (кдж/моль) кристалічного кальцій оксиду дорівнює 635,10, рідкої води − 285,9, кристалічного кальцій гідроксиду − 986,20? Напишіть термохімічне рівняння. В.: Q=203,75 кДж 53. Горіння алюмінію зображується такою схемою рівняння реакції: А1(к.) + О2(г.) ® А12О2(к.). Яка теплота утворення алюміній оксиду, якщо при згоранні алюмінію масою 1,8 г виділилось 55,7 кДж теплоти? Напишіть термохімічне рівняння. В.: Qут В. (А12О3)=1671,0 кДж/моль 54. Розклад глюкози зображується такою схемою рівняння реакції: С6Н12О6(к.) ® С2Н5ОН(р.) + СО2(г.). Яка кількість теплоти виділиться при розкладі глюкози масою 135 г, якщо теплоти утворення (кДж/моль) кристалічної глюкози − 1273,0, рідкого етилового спирту − 277,6, газуватого карбон(ІV) оксиду − 393,5 кДж/моль? Напишіть термо-хімічне рівняння. В.: Q=52,0 кДж 55. Горіння карбон(ІІ) оксиду зображується такою схемою рівняння реакції: СО(г.) + О2(г.) ® СО2(г.). Яка кількість теплоти виділиться при згоранні 100,8 дм3 (н.у.), якщо теплоти утворення (кДж/моль) карбон(ІІ) оксиду та карбон(ІV) оксиду відповідно дорівнюють 110,4 і 393,5? Напишіть термохімічне рівняння. В.: Q=1274 кДж 56. Купрум(ІІ) оксид взаємодіє з вуглецем за такою схемою рівняння реакції: СuО(к.) + С(к.) ® Сu(к.) + СО(г.). Якщо реагує купрум(ІІ) оксид масою 30 г, то поглинається 8,1 кДж теплоти. Яка теплота утворення купрум(ІІ) оксиду, якщо теплота утворення карбон(ІІ) оксиду становить 110,4 кДж/моль? Напишіть термохімічне рівняння. В.: Qут В. (СuО)=132 кДж/моль 57. Розчинення фосфор(V) оксиду у воді зображується такою схемою рівняння реакції: Р2О5(к.) + Н2О(р.) ® НРО3(р.). Яка кількість теплоти виділиться при одержанні метафосфатної кислоти масою 20 г, якщо теплоти утворення (кДж/моль) фосфор(V) оксиду, води та метафосфатної кислоти відповідно дорівнюють: 1546,6, 285,9 і 945,5? Напишіть термохімічне рівняння. В.: Q=7,32 кДж 58. Залізо взаємодіє з сіркою за такою схемою рівняння реакції: Fe + S ® FeS. При взаємодії 7 г заліза із сіркою виділилося 12,1 кДж теплоти. Яка теплота утворення ферум(ІІ) суль-фіду? Напишіть термохімічне рівняння. В.: Qут В. (FeS)=96,8 кДж/моль 59. Схема рівняння реакції некаталітичного окиснення амоніаку така: NH3 + O2 ® N2 + H2O. Утворення азоту об’ємом 3,36 дм3 (н.у.) супроводжується виділенням 115,0 кДж теплоти. Яка теплота утворення амоніаку, якщо теплота утворення води дорівнює 285,9 кДж/моль? Напишіть термохімічне рівняння. В.: Qут В. (NH3)=18,1 кДж/моль 60. Тепловий ефект реакції, схема рівняння якої SО2(г.) + Н2S(к.) ® S(к.) + Н2О(р.), дорівнює 234,50 кДж теплоти. Яка кількість теплоти поглинеться при утворенні сірки масою 4,8 г? Напишіть термохімічне рівняння. В.: Q=11,75 кДж 61. Розчинення фосфор(V) оксиду у воді зображується такою схемою рівняння реакції: Р2О5(к.) + Н2О(р.) ® НРО3(р.). Яка кількість теплоти виділиться при одержанні метафосфатної кислоти масою 180 г, якщо теплоти утворення (кДж/моль) фосфор(V) оксиду, води та метафосфатної кислоти відповідно дорівнюють: 1546,6, 285,9 і 945,5? Напишіть термохімічне рівняння. В.: Q=65,85 кДж 62. Алюміній взаємодіє з хром(ІІІ) оксидом за такою схемою рівняння реакції: Cr2O3(к.) + A1(к.) ® Cr(к.) + A12O3(к.) Який тепловий ефект реакції, якщо теплота утворення алюміній оксиду дорівнює 1675 кДж/моль, а теплота утворення хром(ІІІ) оксиду становить 1141 кДж/моль? Напишіть термохімічне рівняння. В.: Qр.=534 кДж 63. Горіння фосфору зображується такою схемою рівняння реакції: Р(к.) + О2(г.) ® Р2О5(к.). При згоранні фосфору масою 9,3 г виділилося 229,3 кДж теплоти. Яка теплота утворення фосфор(V) оксиду? Напишіть термохімічне рівняння. В.: Qутв.(P2O5)=1528,7 кДж/моль 64. Напишіть вираз константи рівноваги для реакції, схема якої Н2(г.) + S «Н2S(г.) + Q. Як зміниться стан хімічної рівноваги при збільшенні концентрації водню у такій реакції. 65. За температури 50ºС швидкість деякої хімічної реакції 8,1 моль/(дм3×хв). Якою буде швидкість хімічної реакції за температури 30ºС, якщо температурний коефіцієнт (g) реакції дорівнює 3? У скільки разів зменшиться швидкість хімічної реакції? В.: Vр.=0,9 моль/(дм3×хв) 66. Напишіть вираз константи рівноваги для реакції, схема якої NO(г.) + O2(г.) «NO2(г.) + Q. Як зміниться стан хімічної рів-новаги при збільшенні концентрації кисню у такій реакції? 67. Температурний коефіцієнт хімічної реакції дорівнює 2,5. Якою буде швидкість реакції за температури 40ºС, якщо швидкість її протікання при 20ºС становить 0,14 моль/(дм3×хв)? У скільки разів збільшиться швидкість хімічної реакції? В.: Vр.=0,875 моль/(дм3×хв) 68. Напишіть вираз константи рівноваги для реакції, схема якої Н2(г.) + І2(г.) «НІ(г.) + Q. Як зміниться стан хімічної рівно-ваги при зменшенні концентрації водню у такій реакції? 69. Швидкість хімічної реакції за температури 25ºС дорівнює 0,4 моль/(дм3×хв). Яка швидкість цієї реакції за температури 65ºС, якщо температурний коефіцієнт (g) дорівнює 2? У скільки разів збільшиться швидкість хімічної реакції? В .: Vр.=32,4 моль/(дм3×хв) 70. Напишіть вираз константи рівноваги для реакції, схема якої SO2(г.) + O2(г.) «SO3(г.) + Q. Як зміниться стан хімічної рівноваги при зменшенні концентрації кисню у такій реакції? 71. За температури 21ºС швидкість хімічної реакції 0,055 моль/(дм3×хв). Якою буде швидкість хімічної реакції за температури 71ºС, якщо температурний коефіцієнт (g) дорівнює 3? У скільки разів збільшиться швидкість реакції? В.: Vр.=13,365 моль/(дм3×хв). 72. Напишіть вираз константи рівноваги для реакції, схема якої NO(г.) + O2(г.) «NO2(г.) + Q. Як зміниться стан хімічної рівноваги при зменшенні концентрації нітроген(ІV) оксиду у цій реакції? 73. За температури 20ºС швидкість хімічної реакції 0,06 моль/(дм3×хв). Якою буде швидкість хімічної реакції за температури 40ºС, якщо температурний коефіцієнт (g) дорівнює 3? У скільки разів збільшиться швидкість хімічної реакції? В.: Vр.=0,54 моль/(дм3×хв) 74. Напишіть вираз константи рівноваги для реакції, схема якої Н2О(г.) + СO(г.) «СO2(г.) + Н2(г.) +Q. Як зміниться стан хімічної рівноваги при збільшенні концентрації карбон(ІV) оксиду в такій реакції? 75. За температури 10ºС швидкість хімічної реакції 0,03 моль/(дм3×хв). Якою буде швидкість хімічної реакції за температури 50ºС, якщо температурний коефіцієнт (g) дорівнює 3? У скільки разів збільшиться швидкість хімічної реакції? В.: Vр.=2,43 моль/(дм3×хв) 76. Напишіть вираз константи рівноваги для реакції, схема якої С(гр.) + СO2 (г.) «СO(г.) + Q. Як зміниться стан хімічної рівноваги при збільшенні концентрації карбон(VІ) оксиду в такій реакції? 77. Швидкість хімічної реакції за температури 15ºС дорівнює 0,09 моль/(дм3×хв). Яка швидкість цієї реакції за температури 65ºС, якщо температурний коефіцієнт (g) дорівнює 2? У скільки разів збільшиться швидкість хімічної реакції? В.: Vр.=21,87 моль/(дм3×хв) 78. Даний розчин барій гідроксиду Ва(ОН)2 з молярною концентрацією речовини 0,065 моль/дм3. Визначте: а) рН у цьому розчині; б) масу речовини в розчині об’ємом 250 см3. В.: рН=13,1; m(Ba(OH)2)=2,78 г 79. Даний розчин сульфатної кислоти Н2SО4 з молярною концентрацією речовини 0,0048 моль/дм3. Визначте: а) рОН у цьому розчині; б) масу речовини в розчині об’ємом 80 см3. В .: рОН=12; m(Н2SО4)=0,03 г 80. Даний розчин кальцій гідроксиду Са(ОН)2 з молярною концентрацією речовини 0,084 моль/дм3. Визначте: а) рН у цьому розчині; б) масу речовини в розчині об’ємом 240 см3. В .: рН=13,2; m(Сa(OH)2)=1,49 г 81. Даний розчин арсенатної кислоти Н3АsО4 з молярною концентрацією речовини 0,0082 моль/дм3. Визначте: а) рОН у цьому розчині; б) масу речовини в розчині об’ємом 50 см3. В .: рОН=12,39 m(Н3AsО4)=5,8×10−2 г 82. Даний розчин стронцій гідроксиду Sr(ОН)2 з молярною концентрацією речовини 0,0048 моль/дм3. Визначте: а) рН у цьому розчині; б) масу речовини в розчині об’ємом 120 см3. В .: рН=12; m(Sr(OH)2)=8,81 г 83. Даний розчин сульфідної кислоти Н2S з молярною концентрацією речовини 0,0036 моль/дм3. Визначте: а) рОН у цьому розчині; б) масу речовини в розчині об’ємом 270 см3. В .: рОН=11,86; m(Н2S)=3,3×10−2 г 84. Даний розчин барій гідроксиду Ва(ОН)2 з молярною концентрацією речовини 0,0092 моль/дм3. Визначте: а) рН у цьому розчині; б) масу речовини у розчині об’ємом 40 см3. В .: рН=12,4; m(Ba(OH)2)=0,06 г 85. Даний розчин сульфатної(ІV) кислоти Н2SО3 з молярною концентрацією речовини 0,0085 моль/дм3. Визначте: а) рОН у цьому розчині; б) масу речовини у розчині об’ємом 230 см3. В .: рОН=12,23; m(Н2SO3)=0,16 г 86. Даний розчин кальцій гідроксиду Са(ОН)2 з молярною концентрацією речовини 0,0037 моль/дм3. Визначте: а) рН у цьому розчині; б) масу речовини у розчині об’ємом 190 см3. В .: рН=11,9; m(Ca(OH)2)=0,05 г 87. Даний розчин селенатної кислоти Н2SеО4 з молярною концентрацією речовини 0,046 моль/дм3. Визначте: а) рОН у цьому розчині; б) масу речовини у розчині об’ємом 40 см3. В .: рОН=13,0; m(Н2SeO4)=0,27 г 88. Даний розчин стронцій гідроксиду Sr(ОН)2 з молярною концентрацією речовини 0,0018 моль/дм3. Визначте: а) рН у цьому розчині; б) масу речовини у розчині об’ємом 125 см3. В .: рН=11,6; m(Sr(OH)2)=0,03 г 89. Даний розчин молібденової кислоти Н2МоО4 з молярною концентрацією речовини 0,0025 моль/дм3. Визначте: а) рОН у цьому розчині; б) масу речовини у розчині об’ємом 140 см3. В .: рОН=11,7; m(Н2MoO4)=0,06 г 90. Даний розчин кальцій гідроксиду Са(ОН)2 з молярною концентрацією речовини 0,051 моль/дм3. Визначте: а) рН у цьому розчині; б) масу речовини у розчині об’ємом 50 см3. В .: рН=13,0; m(Ca(OH)2)=0,19 г 91. Даний розчин манґанатної(VІ) кислоти Н2МnО4 з молярною концентрацією речовини 0,0016 моль/дм3. Визначте: а) рОН у цьому розчині; б) масу речовини у розчині об’ємом 75 см3. В.: рОН=11,5; m(Н2MnO4)=0,01 г 92. До розчину кальцій хлориду об’ємом 75 см3 з молярною концентрацією речовини 0,2 моль/дм3 долили розчин фосфатної кислоти об’ємом 60 см3 з молярною концентрацією речовини 0,25 моль/дм3. Яка маса осаду утворилась? Напишіть вираз добутку розчинності речовини, що випала в осад? В.: m(Са3(РO4)2)=1,55 г 93. До розчину магній нітрату об’ємом 300 см3 з молярною концентрацією речовини 0,25 моль/дм3 долили розчину натрій гідроксиду об’ємом 150 см3 з молярною концент-рацією речовини 0,6 моль/дм3. Яка маса осаду утворилась? Напишіть вираз добутку розчинності речовини, що випала в осад? В .: m(Mg(OH)2)=2,61 г 94. До розчину натрій силікату об’ємом 200 см3 з молярною концентрацією речовини 0,2 моль/дм3 долили розчин хлоридної кислоти об’ємом 900 см3 з молярною концент-рацією речовини 0,1 моль/дм3. Яка маса осаду утворилась? Напишіть вираз добутку розчинності речовини, що випала в осад? В.: m(Н2SіO3)=3,12 г 95. До 500 см3 розчину хром(ІІІ) нітрату з молярною концентрацією речовини 0,05 моль/дм3 долили розчин натрій сульфату об’ємом 260 см3 з молярною концентрацією речовини 0,3 моль/дм3. Яка маса осаду утворилась? Напишіть вираз добутку розчинності речовини, що випала в осад? В.: m(Cr(ОН)3)=2,575 г 96. До 500 см3 розчину манган нітрату з молярною концент-рацією речовини 0,2 моль/дм3 долили розчин фосфатної кислоти об’ємом 200 см3 з молярною концентрацією ре-човини 0,25 моль/дм3. Яка маса осаду утворилась? Напи-шіть вираз добутку розчинності речовини, що випала в осад? В.: m(Мg3(РO4)2=6,55 г 97. До розчину ферум(ІІІ) хлориду об’ємом 350 см3 з молярною концентрацією речовини 0,2 моль/дм3 долили розчин натрій гідроксиду об’ємом 600 см3 з молярною концентрацією ре-човини 0,2 моль/дм3. Яка маса осаду утворилась? Напишіть вираз добутку розчинності речовини, що випала в осад? В.: m(Fe(OH)3)=4,28 г 98. До розчину плюмбум(ІІ) нітрату об’ємом 240 см3 з молярною концентрацією речовини 0,25 моль/дм3 долили розчин фосфатної кислоти об’ємом 200 см3 з молярною концентрацією речовини 0,25 моль/дм3. Яка маса осаду утворилась? Напишіть вираз добутку розчинності речовини, що випала в осад? В.: m(Рb3(РO4)2)=16,22 г 99. До розчину купрум(ІІ) сульфат об’ємом 50 см3 з молярною концентрацією речовини 0,4 моль/дм3 долили розчин калій гідроксиду об’ємом 100 см3 з молярною концентрацією речовини 0,5 моль/дм3. Яка маса осаду утворилась? Напи-шіть вираз добутку розчинності речовини, що випала в осад? В.: m(Сu(OН)2)=1,96 г 100. До розчину магній сульфату об’ємом 375 см3 з молярною концентрацією речовини 0,2 моль/дм3 долили розчин фосфатної кислоти об’ємом 250 см3 з молярною концентрацією речовини 0,15 моль/дм3. Яка маса осаду утворилась? Напишіть вираз добутку розчинності речо-вини, що випала в осад? В.: m(Мg3(РO4)2=6,55 г 101. До цинк хлориду об’ємом 50 см3 розчину з молярною концентрацією речовини 0,2 моль/дм3 долили 150 см3 роз-чину калій гідроксиду з молярною концентрацією речо-вини 0,2 моль/дм3. Яка маса осаду утворилась? Напишіть вираз добутку розчинності речовини, що випала в осад? В .: m(Zn(OH)2)=11,88 г 102. До розчину калій силікату об’ємом 320 см3 з молярною концентрацією речовини 0,25 моль/дм3 долили розчин нітратної кислоти об’ємом 400 см3 з молярною концент-рацією речовини 0,25 моль/дм3. Яка маса осаду утвори-лась? Напишіть вираз добутку розчинності речовини, що випала в осад? В.: m(Н2SіO3)=3,9 г 103. До розчину купрум(ІІ) нітрату об’ємом 25 см3 з молярною концентрацією речовини 0,4 моль/дм3 долили розчин калій гідроксиду об’ємом 80 см3 з молярною концентрацією ре-човини 0,2 моль/дм3. Яка маса осаду утворилась? Напишіть вираз добутку розчинності речовини, що випала в осад? В .: m(Сu(OН)2)=7,84 г 104. До розчину кобальт(ІІ) нітрату об’ємом 85 см3 з молярною концентрацією речовини 0,4 моль/дм3 долили розчин калій гідроксиду об’ємом 320 см3 з молярною концентрацією ре-човини 0,25 моль/дм3. Яка маса осаду утворилась? Напи-шіть вираз добутку розчинності речовини, що випала в осад? В.: m(Со(ОН)2)=3,162 г 105. До розчину магній нітрату прилили розчин калій фосфату масою 55,5 г з масовою часткою речовини 16%. Яка кількість речовини осаду утворилася? Напишіть вираз добутку розчинності речовини, що випала в осад? В .: п(Mg3(РO4)2)=0,02 моль 106. Урівняйте окисно-відновне рівняння реакції методом електронного балансу. Вкажіть окисник, відновник. Визначте процеси окиснення, відновлення. 1). Cu + HNO3(розв.) ® Cu(NO3)2 + NO + H2O; 2). NaCrO2 + Br2 + NaOH ® NaBr + Na2CrO4 + H2O; 3). Cu + HNO3(конц.) ® Cu(NO3)2 + NO2 + H2O; 4). Zn + H 2 SO 4 (конц.) ® ZnSO4 + SO2 + H2O; 5). As2O3 + HNO3 + H2O ® H3AsO4 + NO + H2SO4; 6). KClO 3 + HCl ® KCl + Cl 2 + H 2 O; 7). KOH + Cl 2 ® KCl + KClO 3 + H 2 O; 9). KMnO 4 + KI + H 2 SO 4 ® MnSO4 + I2 + K2SO4 + H2O; 10). P + HNO 3 ® H 3 PO 4 + NO 2 + H 2 O; 11). K 2 Cr 2 O 7 + HCl(конц.) ® CrC13 + C12 + KC1 + H2O; 12). KOH + Cl 2 ® KCl + KClO 3 + H 2 O; 13). MnO2 + HC1(конц.) ® MnC12 + C12 + H2O; 14). Cr(OH)3 + Br2 + KOH ® K2CrO4 + KBr + H2O. 107. Яка маса срібла виділиться на катоді при пропусканні струму силою 6,5 А через розчин аргентум нітрату впро-довж 30 хв, якщо вихід речовини за струмом становить 75%? Складіть схему електролізу водного розчину даної солі. В.: m(Ag)=9,82 г 108. Яка маса заліза виділиться на катоді при пропусканні струму силою 5,2 А через розчин ферум(ІІІ) хлориду впродовж 20 хв, якщо вихід речовини за струмом становить 87%? Складіть схему електролізу водного розчину даної солі. В.: m(Fe)=1,05 г 109. Яка маса хрому виділиться на катоді при пропусканні струму силою 4,5 А через розчин хром(ІІІ) нітрату впродовж 25 хв, якщо вихід речовини за струмом становить 85%? Складіть схему електролізу водного розчину солі. В.: m(Cr)=1,03 г 110. Яка маса міді виділиться на катоді при пропусканні струму силою 5,6 А через розчин купрум(ІІ) сульфату впродовж 32 хв, якщо вихід речовини за струмом становить 78%? Складіть схему електролізу водного розчину даної солі. В.: m(Cu)=2,78 г 111. Яка маса нікелю виділиться на катоді при пропусканні струму силою 6,8 А через розчин нікол(ІІ) хлориду впро-довж 45 хв, якщо вихід речовини за струмом становить 82%? Складіть схему електролізу водного розчину солі. В.: m(Ni)=4,60 г 112. Яка маса хрому виділиться на катоді при пропусканні струму силою 7,2 А через розчин хром(ІІІ) броміду впродовж 32 хв, якщо вихід речовини за струмом становить 74,5%? Складіть схему електролізу водного розчину солі. В.: m(Cr)=1,85 г 113. Яка маса ртуті виділиться на катоді при пропусканні струму силою 4,8 А через розчин меркурій(ІІ) нітрату впродовж 39 хв, якщо вихід речовини за струмом становить 72%? Складіть схему електролізу водного розчину солі. В.: m(Hg)=8,47 г 114. Яка маса кобальту виділиться на катоді при пропусканні струму силою 6,7 А через розчин кобальт(ІІ) сульфату впро-довж 42 хв, якщо вихід речовини за струмом становить 75%? Складіть схему електролізу водного розчину солі. В.: m(Co)=3,87 г 115. Яка маса мангану виділиться на катоді при пропусканні струму силою 3,6 А через розчин манган хлориду впродовж 23 хвилин? Складіть схему електролізу водного розчину даної солі. В.: m(Mn)=1,42 г 116. Яка маса міді виділиться на катоді при пропусканні струму силою 5,9 А через розчин купрум(ІІ) йодиду впродовж 36 хв? Складіть схему електролізу водного розчину солі. В.: m(Cu)=4,19 г 117. Яка маса свинцю виділиться на катоді при пропусканні струму силою 2,7 А через розчин плюмбум(ІІ) нітрату впро-довж 18 хв? Складіть схему електролізу водного розчину даної солі. В.: m(Pb)=3,13 г 118. Яка маса срібла виділиться на катоді при пропусканні струму силою 6,5 А через розчин аргентум нітрату впродовж 15 хв? Складіть схему електролізу водного розчину даної солі. В.: m(Ag)=6,5 г 119. Яка маса кадмію виділиться на катоді при пропусканні струму силою 6,2 А через розчин кадмій сульфату впродовж 20 хв? Складіть схему електролізу водного розчину солі. В.: m(Cd)=4,32 г 120. Яка маса золота виділиться на катоді при пропусканні струму силою 4,4 А через розчин аурум(ІІІ) нітрату впродовж 15 хв? Складіть схему електролізу водного розчину даної солі. В.: m(Au)=2,69 г
ДОВІДНИКОВИЙ МАТЕРІАЛ
Таблиця 1
|

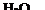 Схема електролізу:
Схема електролізу: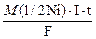 ,
,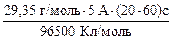 = 1,82 г.
= 1,82 г.



