Задачі з розв’язками
1. Яку масу води необхідно додати до розчину масою 80 г з масовою часткою речовини натрій хлориду 50%, щоб одержати розчин з масовою часткою натрій хлориду 20%?
m (NaC1) = 80 г Масова частка речовини натрій хлориду w 1(%)(NaC1) = 50 у чистій воді дорівнює 0%. w 2(%)(NaC1) = 20 1. Яку масу води треба додати до розчину? m (H2O) −? суємо в лівому стовпчику. У другому (по центру) вказуємо концентрацію розчину, яку треба одержати (кінцеву). Різницю між вихідними концентраціями і кінцевою записуємо в третьому стовпчику, в напрямку діаголей, що перетинаються:
0 30 Одержані числа (20 і 30) вказують на співвідношення за масою, в якому повинні бути змішані вихідні розчини: 20 г (50%) −− 30 г (0%, тобто води) або 2: 3. Складаємо пропорцію і знаходимо з неї масу води, яку треба долити до розчину солі даної маси: 20 г (50%) 30 г (Н2О) 80 г х г 20: 80 = 30: х ® х = Так як густина води становить 1 г/см3, то до даного розчину треба долити води об’ємом 120 см3, відміряного мірним циліндром. Відповідь: m (H2O) = V (H2O) = 120 г.
2. Яка молярна концентрація еквівалента речовини сульфатної кислоти Н2SО4, якщо масова частка речовини в розчині дорівнює 20%, а густина такого розчину становить 1,14 г/см3?
w (H2SO4) = 0,20 1. Яка маса речовини H2SO4 міс- r (H2SO4×розч.)=1,14 г/см3 титься в 1 дм3 такого розчину? с (1/2 H2SO4) −? r (H2SO4×розч.) = ® m (H2SO4×розч.) = r (H2SO4×розч.) × V (H2SO4×розч.); w (H2SO4) = w (H2SO4) = ® m (H2SO4) = w (H2SO4) × r (H2SO4×розч.) × V (H2SO4×розч.), m (H2SO4) = 0,20 × 1,14 × 1000 = 228 (г). 2. Яка молярна маса еквівалента сульфатної кислоти H2SO4? M (fекв. (H2SO4)H2SO4) = fекв. (H2SO4) × M (H2SO4), M (fекв. (H2SO4)H2SO4) = 1/2 × 98 = 49 (г/моль). 3. Яка молярна концентрація еквівалента речовини сульфатної кислоти Н2SО4 у даному розчині? с (1/2 H2SO4) = n (1/2 H2SO4) = с (1/2 H2SO4) = с (1/2 H2SO4) = Відповідь: с (1/2 H2SO4) = 4,65 моль/дм3.
3. Визначити масу солі аргентум хромату Ag2CrO4, що розчи-нена в 250 см3 насиченого розчину за температури 25ºС, якщо ДР(Ag2CrO4) за цих умов дорівнює 4×10−12.
V (Ag2CrO4×розч.)=250 см3 1. Яка молярна концентрація речо- ДР(Ag2CrO4)=4×10−12 вини у насиченому розчині?
m (Ag2CrO4) −? за р.р. 1 моль 2моль 1моль за у.з. х 2 х х ДР(Ag2CrO4) = с 2(Аg1+)× с (CrO42−) ДР(Ag2CrO4) = (2 x)2× x = 4 x 3 4×10−12 = 4 x 3 x = 2. Яка маса речовини розчинена в даному об’ємі розчину? с (Ag2CrO4) = с (Ag2CrO4) = с (Ag2CrO4) = ® m (Ag2CrO4) = с (Ag2CrO4) × М (Ag2CrO4) × V (Ag2CrO4×розч.); m (Ag2CrO4) = 1×10−4 × 332 × 0,25 = 8,3×10−3 (г). Відповідь: m (Ag2CrO4) = 8,3×10−3 г.
4. Визначити рН розчину амоній гідроксиду з молярною кон-центрацією речовини 0,02 моль/дм3 (Кйон.NH4OH) = 1,8×10−5).
с (NH4OH) = 0,02 моль/дм3 1. Яка ступінь йонізації (дисоціа- Кйон .(NH4OH) = 1,8×10−5 ції)? рН −? За законом розбавлення В. Оствальда: a = 2. Яка молярна концентрація продисоційованих молекул амо-ній гідроксиду у розчині? a = сйон. (NH4OH) = 3 × 10−2 × 0,02 = 6 × 10−4 (моль/дм3) 3. Яка молярна концентрація гідроксид-іонів (ОН1−) у розчині? NH4OH = NH41+ + OH1− за р.р. п 1 моль 1 моль за у.з. 6 × 10−4 6 × 10−4 4. Який рОН цього розчину? рОН = −1g с (ОН1−), рОН = −1g (6×10−4) = −(−4 + 0,78) = 3,22. 5. Який рН цього розчину? рН + рОН = 14 ® рН = 14 − рОН, рН = 14 − 3,22 = 10,78. Відповідь: рН = 10,78.
Тема 8
|

 Дано: Розв’язок:
Дано: Розв’язок: Концентрацію вихідних розчинів запи-
Концентрацію вихідних розчинів запи- 50 20
50 20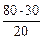 = 120 (г).
= 120 (г). Дано: Розв’язок:
Дано: Розв’язок: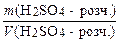 ®
®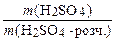 ,
,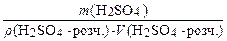 ®
® , так як
, так як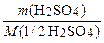 , то
, то ,
, = 4,65 моль/дм3
= 4,65 моль/дм3 tºC = 25ºC Ag2CrO4 2Ag1+ + CrO42−
tºC = 25ºC Ag2CrO4 2Ag1+ + CrO42−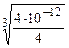 = 1×10−4 (моль/дм3)
= 1×10−4 (моль/дм3) ;
; ; ®
; ® Дано: Розв’язок:
Дано: Розв’язок: =
=  =
= 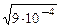 = 3 × 10−2.
= 3 × 10−2. ® сйон. (NH4OH) = a × сзаг .(NH4OH),
® сйон. (NH4OH) = a × сзаг .(NH4OH),


