Вправи та задачі з розв’язками. 1. Процес каталітичного окиснення сульфур (ІV) оксиду відбу-вається на твердому каталізаторі БАВ за таким рівнянням:
1. Процес каталітичного окиснення сульфур (ІV) оксиду відбу-вається на твердому каталізаторі БАВ за таким рівнянням:
Необхідно: а) у відповідності до принципу Ле Шательє вказати, як треба змінити температуру, тиск, концентрацію вихідних і кінцевих речовин для зміщення хімічної рівноваги вправо; б) розрахувати у скільки разів зросте швидкість реакції при збільшенні концентрації вихідних речовин у 3 рази та при підвищенні температури на 60ºС (температурний коефіцієнт реакції дорівнює 3); в) визначити початкові концентрації за відомими рівно-важними молярними концентраціями ([SО3]рівн.= 0,3; [О2]рівн.= 0,4; [SО3]рівн.= 0,2) та розрахувати константу рівноваги реакції, її швидкість у початковий момент, якщо константа швидкості при заданій температурі дорівнює 0,75. г) вказати до якого типу каталітичних процесів відноситься зазначений приклад. Розв’язок: а). Для зміщення рівноваги хімічної реакції вправо необхідно температуру знизити (посилюється екзотермічний процес), тиск підвищити (рівновага зміщується у бік меншої кількості моль газуватих речовин), концентрацію вихідних речовин збільшувати (система посилює процес їх перетворення), кінцеві речовини відводити (це приводить до їх інтенсивного утворення). б). Вплив концентрації на швидкість реакції регламентується законом діючих мас: До підвищення концентрації швидкість хімічної реакції у відповідності із законом діючих мас обчислюється за такою формулою: V 1 х.р. = k [SO2]2 × [O2]; після підвищення концентрації швидкість хімічної реакції обчислюється за такою формулою: V2 х.р. = k (3[SO2])2 × (3[O2]). У скільки разів збільшиться швидкість хімічної реакції після підвищення концентрації початкових речовин?
= 27 раз. У відповідності до правила Вант-Гоффа при підвищенні температури швидкість збільшується:
У випадку, коли ці два фактори діють паралельно, швидкість зростає у: 27 × 729 = 19 683 (рази) в). Виходячи з того, що у початковий момент реакції концентрація продуктів реакції дорівнює нулю, заповнюємо табличку:
К рівн. = V поч. = k [SO2]2 поч. × [O2] поч. = 0,75 × 0,52 × 0,5 (моль×дм3/с)
г). Процес є гетерогенним каталітичним.
Тема 7
|

 2SО2(газ.) + О2(газ.) 2SО3(газ.), ∆Н < 0.
2SО2(газ.) + О2(газ.) 2SО3(газ.), ∆Н < 0.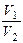 =
= 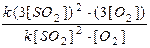 =
=  =
=
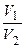 = g = 3 = 36 = 729 (разів)
= g = 3 = 36 = 729 (разів)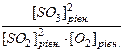 =
=  = 1,1111
= 1,1111


