Екзо- і ендотермічні реакції
Хімічна взаємодія, як правило, супроводжується тепловим ефектом. При цьому теплота може як поглинатись, так і виділятись. Процеси, що протікають з виділенням теплоти, називаються екзотермічними; процеси для яких характерне поглинання теплоти називаються ендотермічними. Рівняння реакцій, що враховують тепловий ефект, називаються термохімічними. Наприклад:
Тепловий ефект реакції необхідно характеризувати не лише абсолютною величиною, але й знаком. Історично склалось дві системи відліку: термохімічна і термодинамічна. У першій із них тепловий ефект екзотермічної реакції прийнято позитивним (екзо- – зовнішній). Ендотермічні реакції супро-воджуються негативним тепловим ефектом, теплота поглинається системою (ендо- – внутрішній). У термодинаміці прийнята зворотна система знаків, тобто теплота, що поглинається системою прийнята позитивною, а теплота, яку система віддала в оточуючий простір – негативною. У термодинамічній системі знаків тепловий ефект реакції ототожнюється із зміною ентальпії системи ∆Н. При записі термодинамічного рівняння в цій системі тепловий ефект не включається в рівняння, а записується у дужках. Так, наведене вище рівняння матиме вигляд: 2Н2(газ) + О2(газ) D 2Н2О(газ) (∆Н = - 476 кДж). Глибоке узагальнення термохімічних закономірностей дає закон термохімії, сформульований у 1836 р. російським академіком Германом Івановичем Гессом: тепловий ефект хімічної реакції, що протікає або при сталому об’ємі або при сталому тиску, не залежить від числа проміжних стадій, а визначається лише початковим і кінцевим станом системи. Закон Гесса можна проілюструвати схемою:
DН = DН1 + DН2 Із закону Гесса витікають такі наслідки: Тепловий ефект реакції утворення одного моля сполуки із простих речовин у стандартному стані при заданих температурі та тиску не залежить від способу утворення сполуки. Даний тепловий ефект називається теплотою утворення. Величина та знак теплоти утворення до певної міри характеризують термодинамічну стійкість сполуки. Ентальпії утворення гідридів елементів V-А групи:
Газуватий амоніак (NН3) є найбільш стійкою сполукою, в той час як PH3 і AsH3 нестійкі, а SbH3 взагалі розкладається у момент утворення, і його теплота утворення визначається непрямим шляхом. У термодинаміці в якості стандартних умов приймаються температура 25°С = 298К і тиск 1,03 × 105 Па. 2. С тандартний тепловий ефект реакції рівний алгеб-раїчній різниці суми стандартних теплот утворення продуктів реакції і суми стандартних теплот утворення вихідних речовин. Другий наслідок закону Гесса дозволяє розрахувати тепловий ефект реакції за теплотами утворення вихідних речовин і продуктів взаємодії. а A + b B = c C + d D, (ΔH°298) ΔH°298 = [ c×; ΔH°298 (С) + d×; ΔH°298 (D)] – − [ a×; ΔH°298 (A) + b×; ΔH°298 (B)]
|

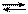 2Н2(газ) + О2(газ) 2Н2О(газ) + 476 кДж.
2Н2(газ) + О2(газ) 2Н2О(газ) + 476 кДж.



