Хімічні властивості
1. Розчинні у воді солі взаємодіють з металом, стандартний окисно-відновний потенціал якого має більш негативне значення, ніж катіон даної солі: CuSO4 + Zn = ZnSO4 + Cu. 2. Сіль реагує з основним гідроксидом (див. властивості основних гідроксидів): MgC12 + NaOH ® Mg(OH)2¯ + NaC1. 3. Сіль реагує з кислотним гідроксидом (див. властивості кислотних гідроксидів): K2CO3 + H2SO4 ® K2SO4 + H2O + CO2. 4. Розчинні солі взаємодіють між собою за умов виконання правила Бертолє-Михайленко: BaCl2 + Na2SO4 ® BaSO4¯ + NaCl AgNO3 + KCl ® AgCl¯ + KNO3 5. Солі взаємодіють з простими речовинами (активніший галоген витісняє слабший): 2KI + Br2 = 2KBr + I2 2NaBr + Cl2 = 2NaC1 + Br2 6. Розчинні у воді солі гідролізують (вступають у взаємодію з водою). Ця властивість має виключно важливе значення, оскільки ми, як правило, маємо справу з розчинами солей. Розглянемо чотири можливі варіанти. а) сіль утворена аніоном слабкої кислоти та катіоном сильної добре розчинної у воді основи:
середовище лужне б) сіль утворена аніоном сильної кислоти та катіоном слабкої або важкорозчинної у воді основи:
належить слабкому основному гідроксиду
 NН41+ + Н+ОН− NН4ОН + Н1+ NН41+ + Н+ОН− NН4ОН + Н1+
середовище кисле або
належить важкорозчинному основному гідроксиду
 І стадія Zn2+ + Н+ОН− (ZnОН)+ + Н1+ І стадія Zn2+ + Н+ОН− (ZnОН)+ + Н1+
середовище кисле в) сіль утворена аніоном слабкої кислоти і катіоном слабкої або важкорозчиної у воді основи:
Має місце повний гідроліз:
йонна форма рівняння
молекулярна форма рівняння середовище близьке до нейтрального г) сіль утворена аніоном сильної кислоти та катіоном сильної основи:
У такому випадку гідроліз солі не відбувається. Середовище в розчині таких солей нейтральне.
|

 Nа2СО3 2Nа1+ + СО32−
Nа2СО3 2Nа1+ + СО32− належить слабкому кислот-
належить слабкому кислот- І стадія СО32− + Н+ОН− НСО31− + ОН1−
І стадія СО32− + Н+ОН− НСО31− + ОН1− Nа2СО3 + Н2О NаНСО3 + NаОН
Nа2СО3 + Н2О NаНСО3 + NаОН NаНСО3 + Н2О Н2СО3 + NаОН
NаНСО3 + Н2О Н2СО3 + NаОН NН4С1 NН41+ + С11−
NН4С1 NН41+ + С11−
 NН4С1 + Н2О NН4ОН + НС1
NН4С1 + Н2О NН4ОН + НС1 Zn(NO3)2 + Н2О (ZnОН)NО3 + НNО3
Zn(NO3)2 + Н2О (ZnОН)NО3 + НNО3 ІІ стадія (ZnОН)+ + Н+ОН− Zn(ОН)2 + Н1+
ІІ стадія (ZnОН)+ + Н+ОН− Zn(ОН)2 + Н1+ (ZnОН)NО3 + Н2О Zn(ОН)2 + НNО3
(ZnОН)NО3 + Н2О Zn(ОН)2 + НNО3 належать слабким гідроксидам
належать слабким гідроксидам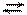 NH41+ + NО21− + Н+ОН− NH4ОН + НNО2
NH41+ + NО21− + Н+ОН− NH4ОН + НNО2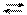 NH4NО2 + Н2О NH4ОН + НNО2
NH4NО2 + Н2О NH4ОН + НNО2 належать сильним гідроксидам
належать сильним гідроксидам


