Ковалентний зв’язок. Метод валентних зв’язків
Умовою утворення стійкої молекули є зменшення потенційної енергії системи атомів, що взаємодіють. Вперше наближені розрахунки потенційної енергії були проведені в 1927 р. В. Гейтлером і Ф. Лондоном для молекули водню. Автори спочатку розглядали систему з двох атомів Гідрогену, що знаходяться на значній віддалі один від одного. За цих умов можна врахувати лише взаємодію електрону з своїм ядром, а всіма іншими взаємодіями знехтувати.
Рис. 4.1. Залежність енергії молекули від між’ядерної відстані а − при однаково напрямлених спінах електронів; б − при протилежно напрямлених спінах електронів; r0 − між’ядерна відстань у молекулі водню При протилежно напрямлених спінах електронів (рис. 4.1, крива б) зближення атомів до певної відстані (r0) супроводжується зменшенням енергії системи. При r = r0 система володіє найменшою потенційною енергією, тобто знаходиться в найбільш стійкому стані, подальше зближення атомів знову приводить до зростання енергії.
1Н ® Н2 1Н ¯ ¯
Уявлення про механізм утворення хімічного зв’язку, розвинуті В. Гейтлером та Ф. Лондоном на прикладі молекули водню, були розповсюджені й на більш складні молекули. Розроблена на цій основі теорія хімічного зв’язку одержала назву метод валентних зв’язків (МВЗ), в основі якого лежать такі положення: 1. Ковалентний хімічний зв’язок утворюється двома електронами з протилежно напрямленими спінами, причому новоутворена електронна пара одночасно належить обом атомам. Комбінації такого двохектронного двоцентрового зв’язку, що відображають електронну будову молекули, одержали назву валентних схем. 2. Ковалентний зв’язок тим міцніший, чим більшою мірою перекриваються електронні хмари, що взаємодіють.
17С1 3 ¯ ¯ ¯ 3 ¯ ¯ ¯ С12: s p ® С12 17С1 3 ¯ ¯ ¯ ¯ 3 ¯ ¯ ¯ ¯
7N 2 ¯ 2 ¯ N2 s p ® N2 7N 2 ¯ ¯ ¯ ¯ 2 ¯ ¯ ¯ ¯
1H 1 ¯ 1 ¯ HC1: s p ® HC1 17C1 2 ¯ ¯ ¯ ¯ ¯ ¯ s p
Полярний та неполярний ковалентний зв’язок Якщо двохатомна молекула складається з атомів одного елемента, то кожна електронна хмара утворена парою електронів, що здійснюють ковалентний зв’язок, розподі-ляється в просторі симетрично відносно ядер атомів. У такому випадку зв’язок називається неполярним. Якщо двохатомна молекула складається з двох різних атомів, то спільна електронна пара зміщена у одного з них, так що виникає асиметрія в розподілі заряду. У таких випадках має місце полярний зв’язок. Для оцінки здатності атома одного з елементів відтягувати на себе спільну електронну пару користуються величиною відносної електронегативності. Чим більша електронегатив-ність атома, тим сильніше він притягує спільну електронну пару.
|

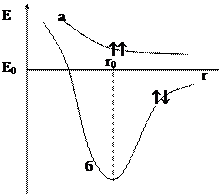 У результаті В. Гейтлер і Ф. Лондон отримали рівняння, що дозволяє знайти залежність потенційної енергії (Е) системи, що складається з двох атомів Гідрогену від відстані (r) між ядрами цих атомів. При цьому виявилось, що результати розрахунків залежать від значення спінового числа електронів (рис. 4.1).
У результаті В. Гейтлер і Ф. Лондон отримали рівняння, що дозволяє знайти залежність потенційної енергії (Е) системи, що складається з двох атомів Гідрогену від відстані (r) між ядрами цих атомів. При цьому виявилось, що результати розрахунків залежать від значення спінового числа електронів (рис. 4.1). Дослідження В. Гейтлера та Ф. Лондона дозволило зробити висновок, що хімічний зв’язок у молекулі водню здійснюється шляхом утворення пари електронів з протилежно напрямленими спінами, що одночасно належать тепер обом атомам.
Дослідження В. Гейтлера та Ф. Лондона дозволило зробити висновок, що хімічний зв’язок у молекулі водню здійснюється шляхом утворення пари електронів з протилежно напрямленими спінами, що одночасно належать тепер обом атомам. Приклади молекул:
Приклади молекул: