Основные формулы для расчета термодинамических процессов идеального газа
1. Изменение внутренней энергии в любом политропном процессе вычисляется по формуле
2. Изменение энтальпии в любом политропном процессе вычисляется по формуле
3. Изменение энтропии в процессах с идеальным газом:
или
4. Уравнения политропного процесса имеют вид:
5. Связь между параметрами p, υ и T в любых двух точках на политропе.
6. Работа изменения объёма газа в политропном процессе имеет вид:
Работа изменения объема изотермического процесса:
7. Работа изменения давления в n больше работы изменения объема:
Для изотермического процесса выражения:
8. Количество подведённой (или отведённой) в процессе теплоты:
где сnm - средняя теплоёмкость политропного процесса:
9. Графическое изображение политропных процессов Чтобы проследить за расположением политропных процессов при различных значениях n в pυ- и Ts – координатах, изображают в этих координатах кривые частных процессов: изохорного n = ±∞, изобарного – n = 0, изотермического – n = 1 и адиабатного – n = k, по которым можно определить относительное положение политроп при других значениях n, а также определить знак q, Δu и l в этих процессах (рис.1). В pυ- координатах изобара (p = const) и изохора (υ = const) изображаются прямыми, параллельными осям абсцисс и ординат соответственно, изотерма (pυ = const) представляет собой равнобокую гиперболу, а адиабата (pυk = const) неравнобокую гиперболу. В Ts – координатах изотерма (Т = const) и адиабата (δq = 0, ds = 0, s = const или изоэнтропа) изображаются прямыми, параллельными осям абсцисс и ординат соответственно, изохора и изобара представляют собой логарифмические кривые, соответственно с формулами (3.9) υ = const и (3.10) при p = const. Задачи
|


 .
.
 ;
;
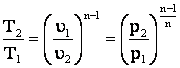 .
.
 ;
l з =
;
l з = 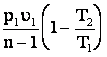 ;
l з =
;
l з = 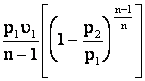 ;
l з =
;
l з = 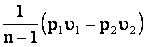 .
.
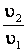 ;
l 3t = RT ln
;
l 3t = RT ln  ;
l 3t = р1υ1 ln
;
l 3t = р1υ1 ln  ;
l 0 =
;
l 0 =  ;
l 0 =
;
l 0 =  .
.
 ;
l 0t
;
l 0t  .
.
 ,
,
 .
.



