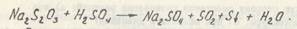Подготовка к выполнению опытов
Тема. Скорость химических реакций. Химическое равновесие.
Теоретическая подготовка Понятие о скорости химической реакции, ее количественном выражении. Значение знания скорости химической реакции для выбора оптимальных условий процесса. Скорость химической реакции в гомогенной и гетерогенной системах. Зависимость скорости химической реакции от концентрации реагирующих веществ. Закон действия масс. Константа скорости реакции. Влияние фактора поверхности на скорость реакций в гетерогенной системе. Зависимость скорости химической реакции от температуры. Температурный коэффициент реакций. Правило Вант-Гоффа. Необратимые и обратимые химические процессы. Признаки обратимых и необратимых химических процессов. Химическое равновесие. Смещение химического равновесия при изменении внешних факторов (концентрации реагирующих веществ, давления и температуры). Принцип Ле-Шателье.
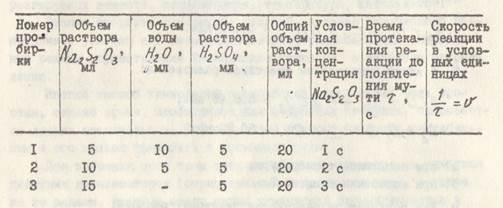
Методические указания Одним из основных параметров химических процессов, осуществляемых в промышленности, является скорость, с которой эти процессы протекают. Учение о скорости химической реакции называется химической кинетикой. Знание скоростей химических реакций имеет большое значение в химической промышленности. Чтобы управлять ходом химического процесса и достигать высокой экономической эффективности химического производства, необходимо уметь регулировать скорости реакций: увеличивать взрывных или других нежелательных реакций. При изучении темы особенно важно выяснить влияние на скорость химических реакций таких основных факторов,как: природа реагирующих веществ, концентрация, температура, катализатор. Знание скорости химических реакций, а также химического равновесия и условий его смещения позволяет разрабатывать оптимальные режимы осуществления химических процессов в заданном направлении. Иногда способ химической переработки сырья может быть простым, однако время, необходимое для получения продукта, оказывается весьма значительным. Поэтому такой процесс не будет рентабельным и его нельзя применять в промышленности. При изучении этой темы следует обратить внимание на механизм действия катализаторов (отрицательных и положительных), а также на те задачи, которые стоят перед химической промышленностью в области катализа. Подготовка к выполнению опытов 1. Зависимость скорости реакции от концентрации реагирующих веществ. В три большие пронумерованные пробирки налить разбавленный (1:200) раствор тиосульфата натрия Na2S2O3: в первую - 5 мл, во вторую - 10 мл, в третью - 15 мл. К содержимому первой пробирки добавить затем 10 мл воды, второй - 5 мл воды. В три другие пробирки налить по 5 мл разбавленной (1:200) серной кислоты. В каждую пробирку с раствором прилить при перемешивании по 5 мл приготовленной H2SO4и определить время с момента добавления кислоты до помутнения раствора в каждой пробирке. Реакция между тиосульфатом натрия и серной кислотой сопровождается помутнением раствора, которое вызвано появлением свободной серы: Время, которое проходит от начала реакции до заметного помутнения раствора, характеризует скорость реакции. Результаты опыта оформить (табл.1). Таблица 1
Те же результаты изобразить графически, отложив на оси абсцисс условные концентрации Na2S2O3, а на оси ординат - скорость реакции 1 / t. Сделать вывод о зависимости скорости реакции от концентрации реагирующих веществ. Согласуются ли ваши наблюдения с законом действия масс? Какой линией выражается данная зависимость? __________________________ Проходит ли она через начало координат? Почему?_______________________ ___________________________________________________________________ Вывод:
|