Контрольные задания. 75. Рассчитать рН в 0,1 моль/дм3 растворе ацетата натрия.
75. Рассчитать рН в 0,1 моль/дм3 растворе ацетата натрия. 76. Вычислить рН смеси, содержащей равные объёмы 5%-ных растворов азотистой кислоты и нитрита натрия. 77. Рассчитать pН водного раствора 0,33% НNO3 (r=1 г/см3). 78. Рассчитать рН 0,025 моль/дм3 раствора угольной кислоты. 79. Вычислить рН раствора, содержащего 4,1 г ацетата натрия в 0,5 дм3 раствора. 80. К 20 мл 0,04 н НС1 прибавлено 45 мл 0,02 н КОН. Найти рН и рОН полученного раствора. 81. Рассчитать рН в 0,1 моль/дм3 растворе формиата калия. 82. Рассчитать концентрацию ионов водорода в растворе НNO3, если pН =2. 83. Рассчитать рН в 0,1 моль/дм3 растворе цианида натрия. 84. Вычислить рН смеси, содержащей равные объёмы 5%-ных растворов аммиака и хлорида аммония. 85. Рассчитать pН водного раствора 0,36% HCl (r=1 г/см3). 86. К 15 мл 0,025 н НС1 прибавлено 10 мл 0,050 н NaOH. Найти рН и рОН полученного раствора. 87. Рассчитать рОН 1% раствора хлорида аммония. 88. Pассчитать pН раствора NaОН с массовой долей 5% (r = 1 г/см3). 89. К 0,2 н НС1 прибавлен равный объем 0,15 н NaOH. Определить рН и рОН полученного раствора. 90. Рассчитать pН 0,02 моль/дм3 раствора муравьиной кислоты HCOOH. 91. Рассчитать рН 0,1 моль/дм3 раствора нитрита натрия. 92. Рассчитать рН буферной смеси, содержащей 0,01 моль аммиака и 0,1 моль хлорида аммония в 1 дм3 раствора. 93. Рассчитать pН раствора гидроксида натрия, если в 500 см3 содержится 0,2 г NaOН. 94. Рассчитать pН и pОН 0,1 моль/дм3 раствора уксусной кислоты. 95. Рассчитать рН 0,1 моль/дм3 раствора карбоната натрия. 96. К 55 мл 0,2 н КОН прибавлено 45 мл 0,2 н НС1. Чему равен рН полученного раствора? 97. Рассчитать рН 2% раствора нитрита натрия. 98. Сколько граммов КОН потребуется для приготовления 250 см3 раствора, pН которого равна 11? 99. Рассчитать концентрацию ионов водорода в 0,2 моль/дм3 растворе сернистой кислоты. 100. К 100 см3 0,1 моль/дм3 раствора уксусной кислоты прибавили 100 см3 0,5 моль/дм3 раствора ацетата натрия. Вычислить рН полученного раствора. 101. Рассчитать рОН 2% раствора нитрата аммония. 102. Вычислить рН раствора, полученного при смешивании 0,1 моль/дм3 раствора аммиака и 0,1 моль/дм3 раствора хлорида аммония. 103. Рассчитать рН 0,1 моль/дм3 раствора фосфата натрия. 104. К 20 мл 0,1 н НС1 прилито 30 мл 0,1 н NaOH. Чему равен рН полученного раствора? 105. Смешали 20 мл 0,1 н NaOH и 10 мл 0,15 н раствора НС1. Вычислить рН полученного раствора.
4. Определение жёсткости воды и методы ее устранения
Жесткость воды отражает содержание в ней ионов кальция и магния. Бикарбонатная (временная) жесткость (Жвр): Ca(HCO3)2 и Mg(HCO3)2. Она почти полностью устраняется при кипячении воды: Сa(HCO3)2 ® CaCO3 ¯ + CO2 + H2O, Mg(HCO3)2 ® MgCO3 ¯ + CO2 + H2O, 2 Mg(HCO3)2 ® (MgOH)2CO3 ¯ + 3 CO2 + H2O. Постоянная жесткость (Жп) воды обусловлена присутствием в ней преимущественно сульфатов и хлоридов кальция и магния и при кипячении не устраняется. Суммарная жесткость воды носит название общей жесткости. Общая жесткость воды: Жобщ.(Н2О) = Жвр. + Жп. Жесткость воды (Q) (степень жесткости принято выражать в миллимолях ионов Са2+ или Mg2+ (или обоих ионов) в 1 дм3 (л) или 1 кг воды (ммоль/дм3, ммоль/кг, моль-экв/л).. В технической литературе встречается единица измерения степени жесткости воды – мг экв/дм3 или мг-экв/кг. Один миллимоль-эквивален-тов жесткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Mg2+. Зная, что молярные массы эквивалентов ионов Са2+ и Mg2+ соответственно равны 20,04 и 12,16 мг/дм3, можно рассчитать обжую жесткость воды (в ммоль/дм3):
Пример 1. Вычислите временную жесткость воды, зная, что в 500 л ее содержится 202,5 г Ca(HCO3)2. Решение:Временная жесткость воды обусловлена наличием соли гидрокарбоната кальция и вычисляется:
Молярная масса эквивалента Ca(HCO3)2 равна: Пример 2. Вычислите карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 н. раствора HCl. Решение:Карбонатную (временную) жесткость рассчитывают умножением объема кислоты (V, мл), пошедшего на титрование на концентрацию кислоты:
|

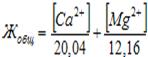 .
.
 , следовательно, жесткость воды:
, следовательно, жесткость воды:  .
.



