
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Романтизм в російському мистецтві. Загальна характеристика
Дата добавления: 2015-08-31; просмотров: 771
|
|
Причины развития ММ у человека и учащения этого заболевания в последние десятилетия остаются неясными. Обсуждаются ряд факторов.
Генетическая предрасположенность, связанная скорее всего с дефектами Т-клеточной супрессорной функции, влияние хронической антигенной стимуляции, радиационные и химические воздействия и вирусные повреждения генома.
Плазмоцитома возникает спонтанно и легко индуцируется у мышей. Опухоль перевивается инбредным животным, хорошо растет в культуре, из которой ее легко перевить животному вновь. Основные исследования по выяснению этиологии и патогенеза заболевания в настоящее время выполняются на чистых линиях мышей. Генетическая предрасположенность к индукции и спонтанному возникновению плазмоцитомы доказывается разной чувствительностью различных инбредных линий мышей и их гибридов.
Расовые различия частоты миеломы у людей, отдельные описания семейных случаев болезни принято расценивать как доказательства известной генетической предрасположенности к заболеванию.
Серьезных аргументов в пользу индуцирующего влияния лучевого воздействия на развитие ММ нет. Этиологическая роль вирусов не доказана.
Методом радиоактивной метки в культурах мышиных и человеческих плазмацитом было показано, что опухоль состоит из пролиферативного и созревающего пула. В пролиферативной части была выделена стволовая самоподдерживающаяся популяция - стволовые клетки опухоли, способные образовывать колонии при трансплантации облученным реципиентам и в культуре. Пролиферирующий пул опухоли состоит в основном из клеток лимфоцитарной структуры.
Плазмоклеточный пул ММ представляет собой конечный этап дифференцировки клеток моноклона, ранние стадии которого находятся на уровне пре-В- или про-В-лимфоцитов, если не самой стволовой клетки кроветворения. Все сказанное убедительно свидетельствует, что при ММ объектом опухолевой трансформации является клетка-предшественница В-лимфоцитов и что, будучи опухолевой, она способна дифференцироваться до конечного этапа - плазмоцита, секретирующего моноклональный Ig.
Современные представления о развитии В-лимфоцитов и этапах их дифференцировки доказывает, что мишенью онкологической трансформации при ММ является поздняя стадия В-лимфоцита - клетки, проделавшей этапы антигензависимой дифференцировки, переключения изотипов Н-цепей Ig и гипермутаций генов вариабельного региона Ig. Основной аргумент этого допущения таков: плазматические клетки при ММ секретируют Ig G, D, А, Е - продукты, характерные для вторичного иммунного ответа, следовательно, прежде чем превратиться в опухолевые, они нормально проконтактировали с антигеном и переключили изотип Н-цепи и несколько изменили вариабельный регион Ig в результате гипермутации.
Возникший в результате вопрос об уровне трансформации В-лимфоцита в опухолевый предшественник миеломы сегодня практического значения не имеет, однако радикальное излечение ММ без элиминации стволового пула опухоли или его надежного сдерживания невозможно. К сожалению, все приемы интенсивной терапии ММ, включая высокодозные миелоаблативные программы и тотальное облучение с последующей алло- или аутотрансплантация костного мозга, не могут привести к полной ликвидации стволовых миеломных клеток, даже так называемые "молекулярные" ремиссии, когда методом ПЦР не обнаруживаются клетки опухолевого моноклона, все же расцениваются как ремиссия, а не излечение, так как неизбежен рецидив.
Частота мутаций клеток плазмоцитомы на 3-5 порядков выше частоты мутаций микробов и нормальных клеток животных.
Изучение типов и частоты мутаций позволило выявить определенные закономерности их появления. С наибольшей частотой (1:1000) возникают мутанты, секретирующие легкие (L) цепи Ig без Н-цепей (миелома Бенс-Джонса). С несколько меньшей частотой продуценты L-цепей превращаются в несекретирущие клетки и далее - в непродуцирующие элементы опухоли. Среди клеток-мутантов возможно появление продуцентов с измененными генами вариабельного региона Ig; частота таких мутаций составляет 0,1-1%. Применение цитостатических средств увеличивает число мутантов. Так, мелфалан не только повышает частоту появления продуцентов L-цепей, но и изменяет структуру Н-цепей (аминокислотные делеции) у 30-40% мутантных клонов.
Строение молекулы иммуноглобулина
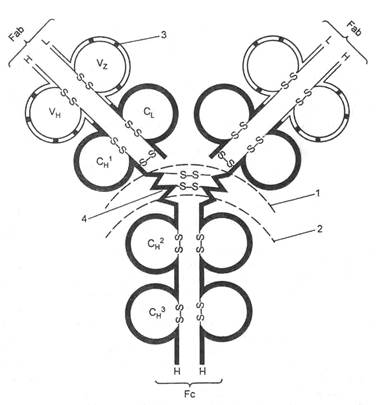
Для того чтобы понять особенности клинического течения ММ, следует, хотя бы кратко, рассмотреть биологию нормальных В-лимфоцитов и плазматических клеток. Развитие и созревание В-лимфоцитов может быть разделено на две основные фазы - антигеннезависимую и антигензависимую. Процесс дифференцировки В-клеток-предшественников в зрелые клетки характеризуется двумя важными событиями; сериями реаранжировок (перестроек) сегментов генов Ig, а также приобретением и потерей поверхностных маркеров в зависимости от последовательности этапов дифференцировки. Первая фаза лимфопоэза происходит у взрослых в костном мозге и является антигеннезависимой. Она включает образование В-линейных клеток из стволовых клеток и их последовательную дифференцировку (видоизменение) в В-клетки-девственницы (virgin-клетки). На данном этапе видоизменения В-клеток сопровождаются перестройками сегментов генов Ig в форму экзонов, ответственных за синтез тяжелых и легких цепей. Гены, кодирующие синтез тяжелых и легких цепей Ig, локализованы в хромосоме 2 (для κ), 22 (для ג) и 14 (для тяжелых цепей). В-клетки-девственницы экспрессируют на своей поверхности следующие маркеры: поверхностные IgM и IgD, а также CD19 и CD20. На этом этапе В-клетки-девственницы покидают костный мозг и мигрируют в периферические лимфоидные органы.
Схема лимфопоэза
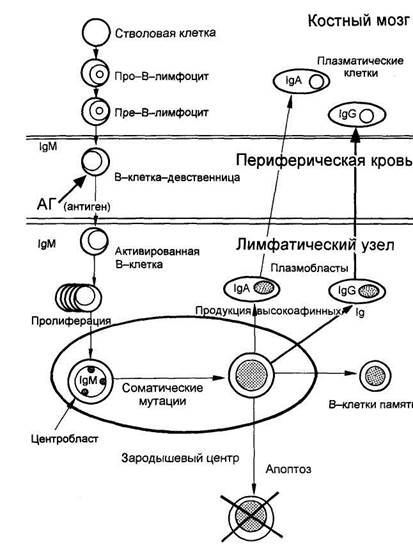
Вторая фаза лимфопоэза осуществляется в периферических лимфоидных органах. После взаимодействия с антигеном происходят активация и клональная пролиферация В-клеток-девственниц. Часть клона В-клеток-девственниц дифференцируется в короткоживущие плазматические клетки, которые всегда локализованы в экстрафолликулярной области лимфатических узлов или красной пульпе селезенки и синтезируют в основном IgM. Другая часть В-клеток-девственниц мигрирует в первичные фолликулы, а затем в терминальный центр лимфатического узла, где впоследствии дифференцируется в центробласты. Эта фаза дифференцировки В-лимфоцитов характеризуется двумя чрезвычайно важными процессами в генах Ig - соматическими гипермутациями и переключением изотипа синтезируемых антител. Соматические мутации происходят в гипервариабельных участках генов Ig. Механизм соматических мутаций связан с переключением изотипа синтезируемых антител.
В зародышевом центре лимфатического узла в присутствии активированных Т-лимфоцитов В-клетки-девственницы претерпевают значительные изменения при взаимодействии с антигенами на поверхности фолликулярных дендритических клеток.
Наиболее важным моментом этого процесса является изотипическое переключение, при котором В-клетки переключаются с синтеза ранее продуцируемого IgM на синтез IgG, IgA или IgE. Переключение происходит преимущественно с синтеза IgM на синтез IgG. Этот класс Ig и является основным в нормальной сыворотке крови человека. Синтез В-клетками IgG свидетельствует о том, что клетка подверглась антигенной стимуляции.
В зародышевом центре центробласты дифференцируются в центроциты. В процессе дальнейшей дифференцировки центроциты с поверхностными антителами, недостаточно соответствующими антигену (низкоаффинные антитела), подвергаются апоптозу. Центроциты, экспрессирующие высокоаффинные антитела, проходят следующий этап дифференцировки и превращаются в клетки памяти и плазмобласты. Плазмобласты возвращаются в костный мозг и при взаимодействии с элементами костномозгового микроокружения созревают окончательно - дифференцируются в зрелые плазматические клетки. Зрелые плазматические клетки продуцируют огромное количество Ig, которые и обеспечивают все разнообразие антител и гуморальную защиту организма.
Дифференцировка В-клеточной линии лимфоцитов в плазматические клетки связана с приобретением или потерей поверхностных маркеров. Точный фенотип нормальных плазматических клеток установлен недостаточно точно из-за малого количества их в образцах нормального костного мозга. Фенотип плазматических клеток имеет две особенности. Первая особенность заключается в том, что в процессе трансформации В-лимфоцитов в плазматические клетки теряется большинство В-специфических маркеров. Второй особенностью является приобретение в процессе трансформации большого количества адгезивных структур.
Наиболее важными маркерами, по которым опухолевые миеломные клетки, вероятно, можно отличить от нормальных плазматических клеток костного мозга, являются экспрессия CD138 в комбинации с высокой экспрессией CD38 и отсутствием экспрессии CD19.
Наличие высокой экспрессии CD138 на плазматических клетках костного мозга является чувствительным и специфичным маркером при ММ. CD138 также экспрессируется плазматическими клетками, циркулирующими в крови, и другими экстрамедуллярными плазматическими клетками, но уровень экспрессии значительно ниже, чем в клетках костного мозга.
CD38 - наиболее характерный поверхностный маркер как миеломных, так и нормальных плазматических клеток. CD38 относится к группе энзимов, участвующих во внутриклеточном обмене кальция.
Важным маркером, позволяющим отличить опухолевые плазматические клетки от нормальных, является экспрессия CD19. Нормальные плазматические клетки обычно экспрессируют CD19, в то время как для миеломных клеток экспрессия CD19 не характерна.
Миеломные клетки всегда несут на своей поверхности СD40 - пан-В-клеточный антиген, который экспрессируется и нормальными плазматическими клетками. Молекулы CD40 относятся к подсемейству рецепторов туморнекротического фактора. В настоящее время сведения о роли этого маркера на миеломных клетках противоречивы. С одной стороны, имеются данные об участии CD40 в клеточной пролиферации, связанной с секрецией ИЛ-6, с другой - опубликованы сообщения о том, что CD40 имеет отношение к прекращению опухолевого роста за счет индукции апоптоза.
В большинстве случаев миеломные клетки имеют высокую экспрессию CD56, в то время как нормальным плазматическим клеткам экспрессия этого маркера не свойственна. Предполагают, что CD56 включается в процессы адгезии и имеет отношение к остеолизу. У больных с ММ при наличии крупных остеолитических очагов выявляются миеломные клетки, несущие CD56, в то время как в отсутствие крупных остеолитических поражений не отмечено экспресии миеломными клетками этого антигена. Потеря CD56 ассоциируется с более агрессивным течением и тенденцией к диссеминации плазматических клеток в периферической крови. CD56 полностью отсутствует на миеломных клетках больных плазмоклеточным лейкозом как в костном мозге, так и в периферической крови.
CD28 - универсальный маркер для выявления прогрессирования при парапротеинемических гемобластозах. Экспрессия его нарастает при прогрессировании заболевания, а также при рецидивах; наиболее высокий уровень CD28 отмечается при экстрамедуллярных рецидивах. Экспрессия этого маркера может иметь прогностическое значение.
Таким образом, при ММ в костном мозге можно выделить два варианта миеломных клеток, различающихся по уровню экспрессии CD56: первый - с иммунофенотипом CD138+++, CD38+++, CD 19-, слабой экспрессией CD40+ и высокой экспрессией CD56+++, второй - с тем же фенотипом по CD138, CD38, CD19 и CD40, но слабой экспрессией CD56+. В процессе прогрессирования болезни экспрессия CD28 нарастает. Экстрамедуллярные миеломные клетки имеют несколько иной фенотип: CD 138+++, CD38+++, CD19-, CD28+ со слабой экспрессией CD56.
Важную роль в процессе созревания и дифференцировки опухолевого клона при ММ играют цитокины. В 1988 г. М.Каwano и соавт. предположили, что интерлейкин-6 (ИЛ-6) стимулирует пролиферацию миеломных клеток. В дальнейшем это предположение было подтверждено и установлено, что ИЛ-6 индуцирует пролиферацию и дифференцировку не только миеломных клеток, но и В-клеток-предшественников патологического клона. Кроме того, ИЛ-6 активирует ряд клеток внекостномозгового происхождения. ИЛ-6 стимулирует синтез белков острой фазы гепатоцитами. По данным исследований, проведенных в начале 90-х годов, ИЛ-6 стимулирует синтез С-реактивного белка (СРБ) в культуре гепатоцитов. В последующие годы для оценки активности ИЛ-6 стали определять уровень СРБ. ИЛ-6 секретируется главным образом стромальными клетками костного мозга и отчасти плазматическими клетками. Высокий уровень ИЛ-6 в сыворотке и большое число рецепторов к ИЛ-6 на поверхности плазматических клеток выявляются при агрессивном течении ММ и прогрессировании болезни. Показано, что введение моноклональных антител к ИЛ-6 не только ингибирует плазмоклеточную пролиферацию миеломных клеток in vitro, но и дает противоопухолевый эффект у больных плазмоклеточным лейкозом.
Некоторые другие цитокины, такие как гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), ИЛ-1, ИЛ-3, ИЛ-5, также стимулируют пролиферацию плазматических клеток при миеломной болезни. ГМ-КСФ и ИЛ-1 усиливают эффект ИЛ-6, а ИЛ-3 и ИЛ-5 стимулируют продукцию миеломными клетками рецепторов к ИЛ-6.
Ряд цитокинов, которые синтезируются миеломными клетками, способны влиять на различные популяции клеток, играющих важную роль в патофизиологии ММ. Известно, что миеломные клетки продуцируют ИЛ-1β, фактор некроза опухоли ФНОα, функционально активный моноцитарно-макрофагальный колониестимулирующий фактор (М-КСФ). Все эти цитокины стимулируют стромальные клетки костного мозга, а также остеокласты, ответственные за резорбтивные процессы в костях. В последние годы показано, что ИЛ-6 также способен активировать остеокласты.
Другая группа цитокинов ингибирует рост миеломных клеток. ИЛ-4 также замедляет пролиферацию миеломных клеток in vivo. На ранних стадиях заболевания определяется высокая концентрация ИЛ-2. Этот цитокин стимулирует цитотоксические Т-лимфоциты к уничтожению миеломных клеток. Выраженной антипролиферативной активностью обладает α-интерферон, наибольшая эффективность которого выявлена в фазе плато миеломной болезни. Таким образом, рост миеломы регулируется множеством цитокинов, как стимулирующих, так и ингибирующих опухолевую пролиферацию.
Важную роль в росте плазмоклеточных опухолей играет микроокружение стромальных клеток костного мозга. В культурах костномозговых стромальных клеток при ММ были идентифицированы четыре крупных популяции клеток: фибробласты, миофибробласты, макрофаги и остеокласты. Стромальные клетки костного мозга секретируют большое количество белков адгезии, что позволяет им захватывать моноклональные клетки - предшественники плазматических клеток. Кроме того, стромальные клетки продуцируют цитокины и таким образом обеспечивают оптимальные условия для локального роста и финальной дифференцировки плазматических клеток.
Несмотря на то, что результаты первого цитогенетического исследования ММ были опубликованы в 1959 году и с тех пор исследовано почти полторы тысячи образцов, мало известно о том, какие хромосомные нарушения характерны для этого заболевания. Лишь у трети обследованных больных были выявлены клональные хромосомные изменения. Изучение кариотипа миеломных клеток значительно затруднено из-за низкой пролиферативной активности патологических плазматических клеток и их предшественников.
Анеуплоидия наиболее характерна для ММ, причем встречается как гипо-, так и гипердиплоидия. Изменения в виде ги-пердиплоидии наиболее часто отмечаются в хромосомах 3, 5, 7, 9, 11, 19 и 21, а в виде гиподиплоидии - в хромосомах 13, 19 и X. Структурные аномалии наиболее часто касаются хромосомы 1 (42% описанных случаев). Точки разрывов могут возникать на любом плече хромосомы. Среди описанных транслокаций, наиболее общей специфической аномалией является транслокация (11;14)(q13;q32). Только она достоверно повторяется как основная хромосомная аномалия и отмечается даже в локальных стадиях заболевания. По мнению ряда авторов, транслокация (11;14) является одной из причин злокачественной трансформации при ММ. Выявление ее более важно на этапе ранней диагностики миеломы и имеет меньшее значение при прогрессировании болезни.
Транслокация (11;14) вовлекает в процесс онкоген BCL-1 и обнаруживается также при других лимфопролиферативных заболеваниях. Впервые она была описана при лимфопролиферативном заболевании, сходным с хроническим лимфоцитарным лейкозом. Теперь эта хромосомная аномалия считается специфической для лимфомы зоны мантии и является наиболее характерной и для В-клеточного пролимфоцитарного лейкоза.
При ММ у больных с аномальным кариотипом прогноз хуже, чем у больных с нормальным кариотипом, но гиперплоидия прогностически более благоприятна.
Как и при других опухолях, при ММ выявляется мутация гена - супрессора опухолевого роста р53. Частота мутаций р53 в костном мозге больных со злокачественными плазмоклеточными пролиферациями колеблется от 10 до 20% и обычно ассоциируется с генерализованными или клинически агрессивными формами заболевания. Наиболее часто эта аномалия отмечается при плазмобластном лейкозе (до 22% случаев).
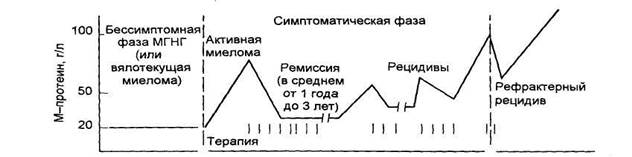
ММ является медленно пролиферирующей опухолью, что подтверждено при изучении пролиферативного индекса плазматических клеток. Index labeling (LI) - это процент активно пролиферирующих клеток, которые выявляются при включении радиоактивной метки - 3Н-тимидина. Как показали исследования кинетики плазматических клеток, у больных с активно текущей миеломой только 1-3% плазматических опухолевых клеток находятся в фазе деления клетки (S-фаза). Клеточный цикл активно пролиферирующих клеток длится от 1 до 3 дней. При ММ плазматические клетки характеризуются низким уровнем экспрессии Ki-67, маркера активного синтеза ДНК. Установлено, что у больных с низким индексом (менее 1%) хроническая фаза болезни может длиться от 1 до 10 лет и лечение заболевания в этой фазе, как правило, успешно. Уменьшение массы опухоли под влиянием терапии приводит к тому, что фаза терапевтического плато наступает несколько раньше, при уменьшении опухолевой массы в 10-100 раз. В этой фазе миеломы количество парапротеина, определяемого в сыворотке и моче, соответствует остаточной массе опухоли.
Ответ на лечение, длительность фазы терапевтического плато и выживаемость больных с ММ зависят от пролиферативной активности плазматических клеток. У больных с низким пролиферативным индексом ответ на лечение появляется медленнее, но фаза терапевтического плато и выживаемость дольше. У больных с высоким пролиферативным индексом (более 3%) и большой опухолевой массой отмечается более быстрый ответ на лечение, но фаза терапевтического плато и выживаемость короткие. В этой группе больных чаще наблюдаются поражение мягких тканей и вовлечение в процесс центральной нервной системы. Несмотря на стабильную массу опухоли, в фазе терапевтического плато нередко отмечается увеличение пролиферирующей фракции в остаточной опухоли и происходят дополнительные мутации, вследствие чего качество пролиферирующих клеток меняется - наступает рецидив заболевания, который менее чувствителен к лечению. Последующие ремиссии становятся все короче, пока не наступит резистентный рецидив - терминальная фаза болезни. В этой фазе синтез патологического протеина может снизиться или прекратиться. Вследствие опухолевой прогрессии и появления мутантных клонов происходят качественные изменения парапротеина, у части больных - переключение с продукции тяжелых цепей на синтез легких. Развивается резистентность к лечению. Все эти данные позволили составить схему клинического течения миеломы.
| <== предыдущая лекция | | | следующая лекция ==> |
| Творчість М.Пнмоненка. | | | Творчість митців об’єднання «Мир искусства». |