
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Пропорційна варіація факторів виробництва.
Дата добавления: 2014-12-06; просмотров: 847
|
|
Титриметрический анализ заключается в измерении объема титранта (раствора с точно известной концентрацией), затраченного на реакцию с определяемым веществом.
Процесс постепенного добавления титранта к анализируемой пробе называется титрованием, а момент завершения реакции – точкой эквивалентности.
Расчет в титриметрическом анализе основан на законе эквивалентов: количества вещества эквивалентов всех участвующих в реакции веществ равны.
Условимся в дальнейшем любое анализируемое вещество обозначать «Х», а любой титрант «Т», тогда закон эквивалентов можно записать следующей формулами:
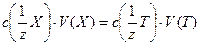
или СН(Х)∙ V(Х) = СН(Т) ∙V(Т)(1)
или 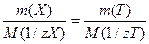 (2) , где
(2) , где
С(1/z Х) или СН(Х) – молярная концентрация эквивалента анализируемого вещества, моль/л или ммоль/л (часто в аналитической химии мэкв/л количество моль-эквивалентов вещества в литре раствора);
V(Х) – объем раствора анализируемого вещества, л или мл;
С(1/z Т) или СН(Т) - молярная концентрация эквивалента титранта, моль/л или ммоль/л (часто в аналитической химии мэкв/л количество моль-эквивалентов вещества в литре раствора);
V(Т) - объем раствора титранта, л или мл;
m(X) - масса анализируемого вещества, г;
m(T) – масса титранта, г;
M(1/zX)- молярная масса эквивалента анализируемого вещества, г/моль;
M(1/zT) - молярная масса эквивалента титранта, г/моль.
(возможны комбинации между формулами 1 и 2)
Выделим три основных задачи, которые необходимо решить для успешного проведения титриметрического анализа.
1. Необходимо знать точную концентрацию титранта (понятие «точная концентрация» здесь условно: ясно, что оперируя экспериментальными данными, имеющими приблизительный характер, мы лишь оговариваем степень точности. Точной будем называть такую концентрацию, которая в числовом выражении имеет три значащих цифры, например: 1,38; 0, 0138; 0,400).
2. Необходимо знать точные объемы растворов реагирующих веществ, т. е. титранта и анализируемого вещества.
3. Необходимо правильно выбирать реакцию для определения и надежно фиксировать точку эквивалентности.
В титриметрическом анализе могут использоваться не все химические реакции, а только те, которые отвечают определенным требованиям. Перечислим основные:
1. реакция должна быть практически необратимой;
2. реакция должна протекать в строгом соответствии с уравнением химической реакции, без побочных продуктов (это требование часто формулируется как «стехеометричность процесса»);
3. реакция должна протекать достаточно быстро;
4. должен существовать способ фиксирования точки эквивалентности.
| <== предыдущая лекция | | | следующая лекция ==> |
| Виробнича функція з двома змінними факторами | | | Оптимум виробника |