
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Економічна сутність витрат виробництва
Дата добавления: 2014-12-06; просмотров: 872
|
|
1.Написать уравнения протекающих химических реакций в молекулярном и ионно-молекулярном виде. Объяснить, почему вода имеет щелочную реакцию. Записать закон эквивалентов. Сделать вывод.
2. Рассчитать временную жесткость воды (Ж врем в мэкв/л) по формуле:
Сн(HCl) · V сред(HCl)
Ж врем = --------------------------------- · 1000
V(H2O)
Опыт 2. Определение ионного состава пробы воды. Качественные реакции на ионы.
Исследуйте пробу воды на качественное присутствие в ней других ионов.
Для выполнения опыта необходимо взять примерно 7-15 мл исследуемой воды и разделить её на 7 частей по 1-2 мл, разлив в пробирки емкостью 10 мл. Затем поочередно выполнить опыты а)….и). Результаты анализа занесите в таблицу, например:
| № п/п | Определяемый ион | Прибавленный реактив | Наблюдения | Вывод |
| а | Железо (III) | Роданид калия | Появляется кроваво-красное окрашивание | Ионы Fe3+ присутствуют |
а) Обнаружение ионов магния.
К 1 мл исследуемой воды прилить 5 капель гидрофосфата натрия Na2HPO4 и 5 капель хлорида аммония NH4Cl и по каплям при постоянном взбалтывании, - раствор аммиака NH4OH. Наблюдать образование белого мелкокристаллического осадка ортофосфата магний-аммония MgNH4PO4, при просматривании на свет шелковистого переливающегося вида. Написать ионную реакцию образования осадка в молекулярном виде.
Mg2++HPO42-+NH3 = MgNH4PO4↓
Запишите уравнение реакции.
б) Обнаружение ионов кальция
Реакция с оксалатом аммония (NH4)2C2O4. К 1 мл исследуемой воды добавляют 5-7 капель раствора оксалата аммония. Смесь нагрейте до кипения и дайте ей постоять 2-3 мин. Выпадает белый кристаллический осадок СаC2O4, растворимый в соляной и азотной кислотах, но не растворимый в уксусной кислоте даже при нагревании. Проверьте и запишите соответствующие уравнения реакций в молекулярной и ионной форме.
в) Обнаружение ионов железа (III).
1. Реакция с гексацианоферратом (II) калия
K4[Fe(CN)6] В пробирку помещают 1 мл исследуемой воды и добавляют столько же раствора K4[Fe(CN)6]. Выпадает осадок темно-синего цвета Fe4[Fe(CN)6]3, называемый берлинской лазурью. Запишите уравнение реакции. Осадок не растворяется в кислотах и растворяется в щелочах с образованием красно- бурого осадка Fe(OH)3:
Fe 4[Fe(CN)6]3 + 12NaOH = 4Fe(OH)3 + 3Na4[Fe(CN)6].
2. Реакция с роданидом калия.
Поместите в пробирку 1 мл исследуемой воды и добавьте 3-5 капель раствора KSCN. При этом появляется кроваво-красное окрашивание, вызванное образованием малодиссоциирующих молекул роданида железа (III) [Fe(SCN)3].
Запишите уравнение протекающих реакций.
г) Обнаружение ионов железа (II).
Реакция с гексацианоферратом (III) калия K3[Fe(CN)6] В пробирку помещают 1 мл исследуемой воды и добавляют столько же раствора K3[Fe(CN)6]. Выпадает осадок темно-синего цвета (турнбулева синь) Fe3[Fe(CN)6]2. Осадок не растворяется в кислотах и растворяется в щелочах с образованием гидроксида железа (II). Проверьте и запишите соответствующие уравнения реакций.
д) Обнаружение ионов свинца (II).
Реакция с иодидом калия. В пробирку помещают 1 мл исследуемой воды и приливают 3-6 капель раствора иодида калия. Выпадает золотисто-желтый осадок. Запишите уравнение реакции в молекулярной и ионной форме.
е) Обнаружение ионов меди (II).
1. Реакция с аммиаком.
К 1 мл исследуемой воды по каплям добавить раствор аммиака до растворения выпавшего осадка. При действии избытка аммиака появляется интенсивное синее окрашивание, вызванное образованием аммиаката меди (II). Запишите уравнение реакции.
2. Реакция с роданидом калия.
К 1 мл исследуемой воды прибавляют 5-7 капель раствора KSCN. Образуется черный осадок роданида меди. Запишите уравнение протекающих реакций.
ж) Обнаружение ионов хлора.
Реакция с нитратом серебра. К 1 мл исследуемой воды добавьте несколько капель нитрата серебра. В присутствии хлорид-ионов образуется белый осадок хлорида серебра, который не растворяется в азотной кислоте, но растворяется в растворах аммиака, карбоната аммония. Запишите соответствующие уравнения реакций в молекулярной и ионной форме.
з) Обнаружение сульфат-ионов.
Реакция с хлоридом бария. К 1 мл исследуемой воды добавьте несколько капель раствора хлорида бария. В присутствии сульфат-ионов образуется белый осадок сульфата бария, который не растворим в азотной кислоте. Запишите соответствующие уравнения реакций в молекулярной и ионной форме.
Контрольные вопросы:
1. Какие виды жесткости вам известны? Какими ионами обусловлен тот или иной вид жесткости?
2. В каких единицах измеряется жесткость и как она рассчитывается?
3. На чем основано определение временной жесткости воды?
4. Каков состав природных вод?
5. Чем обусловлено наличие органических примесей в природных водах?
6. Перечислите ионы, наиболее распространенные в природных водах.
Примечание 1: химический состав коммерческих минеральных вод, мг/л
| HCO3- | Cl- | Ca2+ | Mg2+ | Na+-K+ | H2SiO3 | SO42- | H3BO3 | CO2 | |
| Новотерская | 1300-1600 | 300-500 | 300-400 | <100 | 800-1100 | 30-70 | 1300-1600 | ||
| Славяновская | 1200-1500 | 250-350 | 250-350 | <50 | 600-800 | 800-1000 | |||
| Ессентуки целебная | 1600-1800 | 1800-2000 | <250 | <100 | 2100-2400 | 100-180 | 1300-1600 | ||
| Bon*aqua | <150 | <150 | <80 | <50 | <30 | <80 | |||
| Aqua Minerale | |||||||||
| Ессентуки 4 | 3400-4800 | 1300-1900 | <150 | <100 | 2000-3000 | <25 | 30-60 | 500-1800 | |
| Ессентуки 17 | 4900-6500 | 1700-2800 | 50-200 | <150 | 2700-4000 | <25 | 40-90 | 500-2350 | |
| Боржоми | 3500-5000 | 250-500 | 20-100 | 1200-2000 |
Примечание 2: для приготовления 0,1н раствора кислоты для титрования, следует воспользоваться формулой:
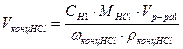 ;
; 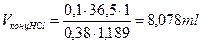 , т.е. для приготовления 1 литра 0,1н раствора соляной кислоты необходимо взять 8,078 мл соляной кислоты, концентрацией 38 % плотностью 1,189 г/мл.
, т.е. для приготовления 1 литра 0,1н раствора соляной кислоты необходимо взять 8,078 мл соляной кислоты, концентрацией 38 % плотностью 1,189 г/мл.
| <== предыдущая лекция | | | следующая лекция ==> |
| Ізокоста за своїм змістом і властивостями є аналогом бюджетної лінії споживача. | | | Витрати виробництва у короткостроковому періоді |