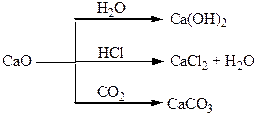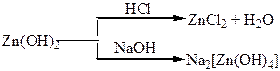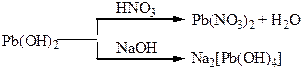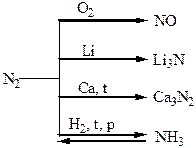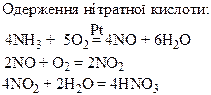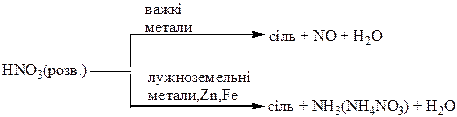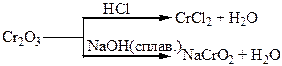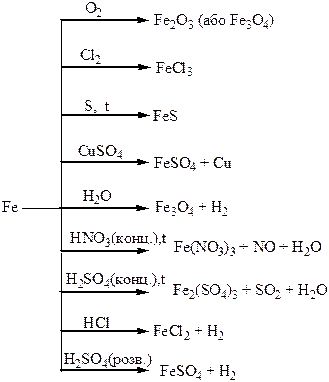Хімія деяких елементів
Таблиця 1.5– Хімія елементів І та ІІ груп
| Ознаки порівняння
| І група
головна підгрупа
(Li, Na, K, Rb, Cs, Fr)
| І група
побічна підгрупа
(Сu, Ag, Au)
| ІІ група
головна підгрупа
(Be, Mg, Ca, Sr, Ba, Ra)
| ІІ група
побічна підгрупа
(Zn, Cd, Hg)
| |
|
|
|
|
| | Будова валентного електронного шару
| ns1
| (n – 1)d10ns1
| ns2
| (n – 1)d10ns2
| | Ступінь окиснення
| +1
| +1, +2
| +2
| Zn - +2, Hg - +1, +2
| | Фізичні властивості простих речовин
| Лужні метали дуже м’які, білого кольору з сріблястим блиском.
| Метали, червоного (мідь), білого (срібло) та жовтого (золото) кольорів з металевим блиском.
| Mg і лужноземельні метали (Ca, Ba) – м’які, білого кольору з сріблястим блиском.
| Метали білого кольору з сріблястим блиском, ртуть – срібляста рідина.
| | Хімічні властивості
простих речовин
| Лужні метали дуже активні, сильні відновники.
| Малоактивні метали.
| Лужноземельні метали – активні, сильні відновники.
| Метали середньої активності.
| | Одержання простих речовин
| Електроліз розплавів солей.
| Добувають з руд (CuFeS2, Ag2S).
| Електроліз розплавів солей.
| Добувають з руд відновленням та електролізом розчинів
| | Сполуки
| Гідриди – MetH.
Оксиди – Met2O.
Гідроксиди– MetOH – луги:
тверді кристалічні речовини, типово йонні сполуки, сильні основи.
Солі – типово йонні сполуки, як правило добре розчинні у воді.
| Оксиди – MetO, Met2O.
Гідроксиди – Cu(OH)2 – основа желеподібна, нестійка на повітрі.
Солі – йонні сполуки, розчинність у воді різна.
| Оксиди MetO – основного характеру.
Гідроксиди– Met(OH)2 –
тверді кристалічні речовини, типово йонні сполуки, основи середньої сили.
Солі – йонні сполуки, розчинність у воді різна.
| Оксид (ZnO) і гідроксид (Zn(OH)2) – амфотерного характеру. Тверді кристалічні речовини, типово йонні сполуки.
Солі – йонні сполуки,
розчинність у воді різна.
| | Продовження таблиці 1.5
| |
|
|
|
|
| | Находження в природі
| Найбільш розповсюджені сполуки натрію:
NaCl – кухонна сіль;
Na2SO4·10H2O – Глауберова сіль;
NaNO3 – чілійська селітра.
KCl – сильвін;
KCl+NaCl – сильвініт.
| CuFeS2 – мідний колчедан;
Cu2S – мідний блиск.
Ag2S – сульфідні руди.
Срібло і золото зустрічаються у самородному стані.
| Сполуки кальцію найбільш розповсюджені:
CaCO3 – крейда, мармур, вапняк;
CaCO3·MgCO3 – доломіт;
CaSO4·H2O – гіпс.
MgCO3 – магнезит.
| ZnS – цинкова обманка;
ZnCO3 – галлей.
HgS – кіновар.
| Хімічні властивості простих і складних речовин, утворених атомами деяких елементів І групи





Хімічні властивості простих і складних речовин, утворених атомами деяких елементів ІІ групи

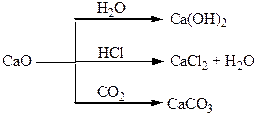


Рис. 1.5. Види твердості води

Рис. 1.6. Методи усунення твердості води


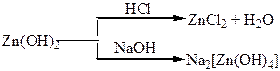
| Таблиця 1.6 – Хімія елементів ІІІ та ІV груп
| | Ознаки порівняння
| ІІІ група
головна підгрупа
(B, Al, Ga, In, Tl)
| ІV група
головна підгрупа
(C, Si, Ge, Sn, Pb)
| |
|
|
| | Будова валентного електронного шару
| ns2np1
| ns2np2
| | Ступінь окиснення
| Al - +3
| +2, +4, (-4)
| | Фізичні властивості
простих речовин
| Метал алюміній легкий, білого кольору з сріблястим блиском, пластичний.
| Карбон – 3 алотропні модифікації (алмаз, графіт, карбін). Аморфний кремній – бурий інертний порошок, алмазоподібна реакційно здатна модифікація – металевий блиск, електропровідність. Олово – сріблясто-білий метал. Свинець – метал голубуватого кольору.
| | Хімічні властивості
простих речовин
| Метал середньої активності, відновник.
| Карбон, силіцій – неметали середньої активності.
Свинець досить інертний метал.
| | Одержання простих речовин
| Електроліз розплавів солей.
| В природі існують поклади графіту.
Кремній добувають відновленням оксиду і солей силіцію магнієм чи цинком, олово – відновленням SnO2 коксом, свинець – з сульфідних руд.
| | Сполуки
| Оксид (Al2O3) і гідроксид (Al(OH)3) – амфотерного характеру. Тверді кристалічні речовини, типово йонні сполуки.
Солі – йонні сполуки, розчинність у воді різна.
| Оксиди – неMetO, неMetO2 – кислотного характеру. Гідроксиди – H2SiO3, H2СO3, – слабкі кислоти, нестійкі.
MetO, Met(OH)2 – амфотерні: MetO2, Met(OH)4 – основні.
| | Находження в природі
| Гірські породи – алюмосилікати.
Al2O3·nSiO2 – глини;
Al2O3·nH 2O – боксити;
Na3AlF6 – кріоліт.
| Карбон находіт до складу кам’яного вугілля, нафти. природних газів.
CaCO3 – крейда, мармур, вапняк;
CaCO3·MgCO3 – доломіт;
MgCO3 – магнезит.
SiO2 – пісок, кварц; силікати.
PbS – свинцевий блиск.
|
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів ІІІ групи



Хімічні властивості простих і складних речовин, утворених атомами деяких елементів ІV групи






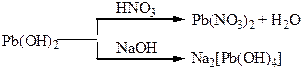

| Таблиця 1.7 – Хімія елементів V та ІV груп
| | Ознаки порівняння
| V група
головна підгрупа
(N, P, As, Sb, Bi)
| VІ група
головна підгрупа
(O, S, Se, Te, Po)
| |
|
|
| | Будова валентного електронного шару
| ns2np3
| ns2np4
| | Ступінь окиснення
| +2, +3, +4, +5.
| Оксисен – 2, Сульфур – 2, +4, +6.
| | Фізичні властивості
простих речовин
| Азот – безбарвний газ без запаху.
Алотропні модифікації фосфору – білий, червоний, чорний фосфор.
Миш’як – метал.
| О2 – безбарвний газ без запаху. Алотропна модифікація оксигену – озон О3 – безбарвний газ з запахом свіжості.
Алотропні модифікації сульфуру – сірка ромбічна, пластична, кристалічна.
| | Хімічні властивості
простих речовин
| Атоми неметалевих елементів можуть віддавати від одного до п’яти електронів в реакціях з простими і складними речовинами.
| Кисень і сірка – активні неметали.
| | Одержання простих речовин
| Азот одержують ректифікацією повітря.
Фосфор одержують електротермічним методом з суміші кальцій фосфату, піску та коксу.
| Кисень добувають електролізом води, ректифікацією повітря.
Сірку добувають з руд або з самородної сірки.
| | Сполуки
| Оксиди Нітрогену і Фосфору – кислотні оксиди.
Кислоти: HNO3, HNO2, H3PO4.
NH3 – амоніак.
Солі: Са3(РО4)2 – “фосфоритна мука”;
Са3(РО4)2 + 2Н2SO4 = Са(H2РО4)2 + 2CaSO4 – суперфосфат;
Са3(РО4)2 + 4Н3РО4 = 3Са(H2РО4)2 – подвійний суперфосфат;
Са(ОН)2 + Н3РО4 = СаНРО4 + 2Н2О – преципітат;
3NH3 + Н3РО4 = NH4H2PO4 + (NH4)2HPO4 – амофос.
| H2S – безбарвний газ з неприємним запахом, токсичний, сильний відновник.
SO3, SO2 – безбарвні гази з різким запахом, кислотні оксиди, ангідриди відповідних кислот.
H2SO4 – сильна кислота, H2SO3 – слабка кислота.
| | Находження в природі
| Азот – 78, 16% повітря;
NаNO3 – чилійська селітра.
Са3(РО4)2 – фосфорит;
3Са3(РО4)2·СаF2 – апатит.
| Кисень – 23% за масою повітря.
Самородна сірка;
FeS2 – пірит, залізний колчедан;
ZnS – цинкова обманка;
Cu2S – мідний блиск.
| Хімічні властивості простих і складних речовин, утворених атомами деяких елементів V групи
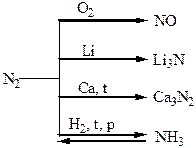

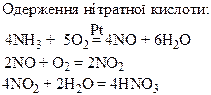


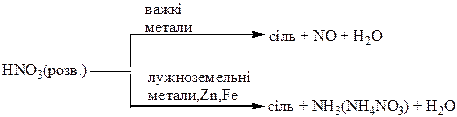

Термічний розклад нітратів металів:





Хімічні властивості простих і складних речовин, утворених атомами деяких елементів VІ групи












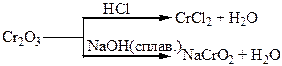



Таблиця 1.8 – Хімія елементів VІІ та VІІІ груп
| Ознаки порівняння
| VІІ група
головна підгрупа
(F, Cl, Br, I, At)
| VІІІ група
побічна підгрупа
(Fe, Ru, Os)
| |
|
|
| | Будова валентного електронного шару
| ns2np4
| ns2np6(n – 1)d6
| | Ступінь окиснення
| -1, +1, +3, +5, +7.
| Fe – +2, +3
| | Фізичні властивості
простих речовин
| Сl2 – жовтий токсичний газ,
Br2 – коричнева рідина,
І2 – чорно-фіолетова кристалічна речовина.
Розчинність у воді знижується від хлору до брому.
| Залізо – сріблясто білий метал, легко намагнічується, має добру електро- і теплопровідність.
| | Хімічні властивості
простих речовин
| Найактивніші неметали.
| Залізо досить активний метал, тому взаємодіє з більшістю простих і складних речовин.
| | Одержання простих речовин
| Хлор одержують електролізом натрій хлориду.
Бром і йод одержують з відповідних солей.
| Залізо отримують шляхом відновлення воднем його оксидів або хлоридів.
| | Сполуки
| Водний розчин НСl – хлоридна кислота, яка має характерні властивості сильних кислот.
СаСl(ОСl) – хлорне вапно, дуже сильний окисник.
Властивості бромідної кислоти аналогічні властивостям хлоридної, але ця кислота більш сильна (більш сильний відновник).
| FeO, Fe2O3 – основні оксиди.
Fe(OН)2, Fe(OН)3 – основи.
| | Находження в природі
| NaCl – кам’яна сіль;
КСl·NaCl – сильвініт.
Бром входить до складу цих руд, як домішки.
| FeS2 – пірит, залізний колчедан;
Fe3O4 – магнітний залізняк;
Fe2O3 – червоний залізняк;
Fe2O3·3Н2О – бурий залізняк
|
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів VІІ групи



Хімічні властивості простих і складних речовин, утворених атомами деяких елементів VІІІ групи
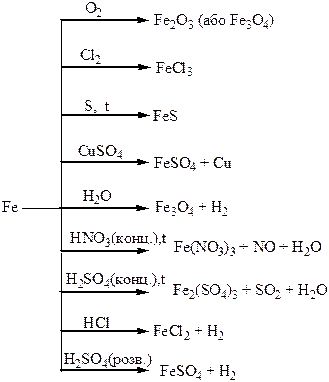






Аальтернативная стоимость. Кривая производственных возможностей В экономике Буридании есть 100 ед. труда с производительностью 4 м ткани или 2 кг мяса...
|

Вычисление основной дактилоскопической формулы Вычислением основной дактоформулы обычно занимается следователь. Для этого все десять пальцев разбиваются на пять пар...
|

Расчетные и графические задания Равновесный объем - это объем, определяемый равенством спроса и предложения...
|

Кардиналистский и ординалистский подходы Кардиналистский (количественный подход) к анализу полезности основан на представлении о возможности измерения различных благ в условных единицах полезности...
|
Медицинская документация родильного дома Учетные формы родильного дома № 111/у Индивидуальная карта беременной и родильницы
№ 113/у Обменная карта родильного дома...
Основные разделы работы участкового врача-педиатра Ведущей фигурой в организации внебольничной помощи детям является участковый врач-педиатр детской городской поликлиники...
Ученые, внесшие большой вклад в развитие науки биологии Краткая история развития биологии. Чарльз Дарвин (1809 -1882)- основной труд « О происхождении видов путем естественного отбора или Сохранение благоприятствующих пород в борьбе за жизнь»...
|
Тема: Изучение приспособленности организмов к среде обитания Цель:выяснить механизм образования приспособлений к среде обитания и их относительный характер, сделать вывод о том, что приспособленность – результат действия естественного отбора...
Тема: Изучение фенотипов местных сортов растений Цель: расширить знания о задачах современной селекции. Оборудование:пакетики семян различных сортов томатов...
Тема: Составление цепи питания Цель: расширить знания о биотических факторах среды. Оборудование:гербарные растения...
|
|