Специфические реакции
Образование пептидов. Аминогруппа одной аминокислоты может взаимодействовать с карбоксильной группой второй, образуя пептиды (соединения, состоящие из остатков аминокислот, связанных пептидной связью):
глицин аланин CH3 дипептид глицилалании Дипептид имеет свободные –NH2 и –COOH группы и может взаимодействовать еще с одной молекулой аминокислоты, образуя трипептид, затем еще с одной молекулой – тетрапептид и т.д. При соединении друг с другом большого числа аминокислот образуются полипептиды.
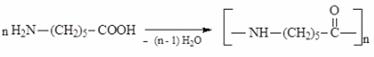
дипептид глицилалании серин трипептид глицилаланинсерин Полипептидная цепь – основа белковых молекул, белки – это природные полипептиды. Поликонденсация. Поликонденсацией ε – аминокапроновой кислоты (6-аминогексановой кислоты) получают синтетическое волокно «капрон».
Как мы увидим далее, поликонденсация аминокислот (отличных от тех, которые образуют полипептиды и белки) используется при получении очень ценных синтетических волокон, например капрона.
|


 O
O