Метил-2-оксипентановая лейцин
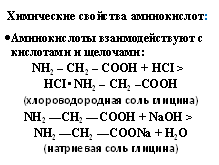
Кислота ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
1)Аминокислоты взаимодействуют с кислотами: NH2 – CH2 – COOH + HCI → HCI• NH2 – CH2 –COOH (хлороводородная соль глицина) 2)Аминокислоты взаимодействуют с щелочами: NH2 —CH2 —COOH + NaOH → NH2 —CH2 —COONa + H2O (натриевая соль глицина) 3) Дезаминирование азотистой кислотой:
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота — в гидроксикислоту: Измерение объема выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка). Реакция этерификации (со спиртами в присутствии газообразного хлороводорода (НСI) H2N-CH(R)-COOH + R'OH → H2N-CH(R)-COOR' + Н2О. Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир (точнее, в хлороводородную соль эфира).
|

 В растворе аминокислоты могут выступать в роли как кислот, так и оснований, т. е. они являются амфотерными соединениями. Карбоксильная группа -СООН способна отдавать протон, функционируя как кислота, а аминная - NH2 — принимать протон, проявляя таким образом свойства основания.
В растворе аминокислоты могут выступать в роли как кислот, так и оснований, т. е. они являются амфотерными соединениями. Карбоксильная группа -СООН способна отдавать протон, функционируя как кислота, а аминная - NH2 — принимать протон, проявляя таким образом свойства основания.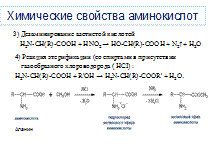 H2N-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑ + H2O
H2N-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑ + H2O


