Состояние белка, при котором суммарный заряд его равен нулю, называется изоэлектрическим состоянием
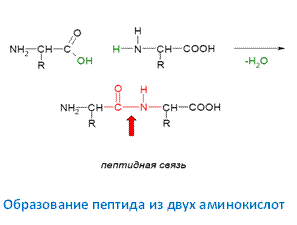
Концентрация водородных ионов (рН), при которой белок находится в изоэлектрическом состоянии называется изоэлектрической точкой белка и обозначается рI. При значении концентрация водородных ионов, равном изоэлектрической точке, аминокислоты не перемещаются в электрическом поле. Если концентрация водородных ионов ниже изоэлектрической точки, катион аминокислоты движется к катоду, а при pH выше ИЭТ анион аминокислоты — к аноду. В изоэлектрической точке ионы белка не переносятся ни к аноду, ни к катоду. В этой точке достигают своего минимального значения такие свойства белков как: набухание, вязкость, электропроводность. Резко падает растворимость белка и увеличивается его способность к свертыванию. На этих свойствах аминокислот основана возможность разделения их в электрическом поле (электрофорез). Кислые аминокислоты имеют ИЭТ в слабокислой среде, основные — в слабоосновной, а нейтральные — в нейтральной. В изоэлектрической точке отсутствие заряда у молекул белка ослабляет силы отталкивания между белковыми частицами, что благоприятствует агрегации белковых молекул и выпадению белка в осадок, т.е. в изоэлектрической точке раствор белка неустойчив, так как белок теряет один из факторов стабилизации белковых водных растворов – заряд. При добавлении щелочи или кислоты к белку, выпавшему в осадок в изоэлектрическом состоянии, наступает перезарядка его молекул, и белок вновь переходит в раствор – растворяется. Так например изоэлектрическая точка (рI) белков … лежит при следующих рН: Желатин -4, 2; Казеин – 4, 6; Альбумин яйца – 4, 8; Альбумин сыворотки крови -4, 8; Гемоглобин – 6, 8; Гистон зобной железы 8, 7. В зависимости от соотношения в белке основных (NH-аминных) и кислых (–СООН карбоксильных) группировок и рН среды молекула белка в водном растворе приобретает положительный или отрицательный заряд. Большинство белков животного происхождения содержат в своем составе больше дикарбоновых аминокислот аспарагиновой и глютаминовой и поэтому в водных растворах они заряжаются отрицательно (белки-анионы). Некоторые белки содержат в своем составе значительные количества диаминокислот (аргинина, лизина, гистидина) и поэтому заряжаются положительно (белки-катионы). Одноименный заряд молекул способствует взаимному отталкиванию частиц, что обеспечивает устойчивость их в водном растворе. Образование пептида из двух аминокислот идет с выделением молекулы воды.
Соответственно, при образовании трипептида будет выделяться уже две молекулы воды. При образовании белка из n – молекул аминокислот, выделится (n – 1) молекул воды. Поэтому процесс образования пептидов и белков называется не полимеризацией, а поликонденсацией. Остаток аминокислоты со свободной α – аминогруппой называется N-концевым, остаток аминокислоты с α -карбоксильной группой называется С - концевым, т.е. остаток треонина в данном трипептиде будет являться N – концом, а остаток тирозина С – концом. Последовательность соединения остатков аминокислот может быть выражена следующим образом: Н2N-Тhr-Phe-Tyr-COOH Название пептидов строятся, перечисляя все аминокислоты кроме С - концевой в виде радикалов, оставляя название С – конца неизменным. Трипептид Nhr-Phe-Tyr будет называться следующим образом: треон ил – фенилалан ил - тироз ин Отличие пептидов от белков состоит в том, что пептиды обладают низкой молекулярной массой, а белки – высокой. Граница между ними очень размыта и лежит в районе 10000 Д (иногда приводятся значения от 5000, 6000). Важным отличием пептидов от белков является их способность проникать через полупроницаемую мембрану, то есть диализуемость.
МОЛЕКУЛА ИНСУЛИНА, построенная из 51 аминокислотного остатка, фрагменты одинаковых аминокислот отмечены соответствующей окраской фона. Содержащиеся в цепи остатки аминокислоты цистеина (сокращенное обозначение ЦИС) образуют дисульфидные мостики –S-S-, которые связывают две полимерных молекулы, либо образуют перемычки внутри одной цепи.
NH2 содержат реакционно-способные сульфгидридные группы –SH, которые взаимодействуют между собой, образуя дисульфидные мостики –S-S-. Роль цистеина в мире белков особая, с его участием образуются поперечные сшивки между полимерными белковыми молекулами. Объединение аминокислот в полимерную цепь происходит в живом организме под управлением нуклеиновых кислот, именно они обеспечивают строгий порядок сборки и регулируют фиксированную длину полимерной молекулы
Шесть молекул инсулина ассоциированы в гексамер (видны три симметричные оси). Молекулы удерживают вместе остатки гистидина, связанные ионами цинка. Введенный инсулин находится под кожей в виде гексамера, постепенно распадаясь на биологически активные мономеры, поступающие в кровоток.
Рисунок – Ассоциация 6 молекул инсулина КЛАССИФИКАЦИЯ ПЕПТИДОВ
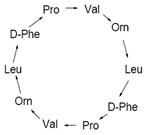
дипептиды, трипептиды, тетрапептиды, пентапептиды; 2 По наличию циклов: ациклические и циклические; 3 По связям между остатками аминокислот: гомодетные пептиды, гетеродетные пептиды; 4 Классификация может сочетаться: 4 – например, антибиотик – грамицидин S – это циклический, гомодетный декапептид (т.е. он содержит 10 аминокислотных остатков, которые связаны исключительно пептидными связями, образуя цикл).
ФУНКЦИИ ПЕПТИДОВ Основная функция пептидов: 1) Регулирующая функция: гормоны (окситоцин, вазопрессин, инсулин, глюкагон, соматостатин, эндорфины); 2) Бактериостатический эффект: антибиотик (грамицидин, аманитин – пептид бледной поганки)
УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКОВ Как уже было сказано, белки представляют собой полипептиды, в молекулу которых входит от пятидесяти до нескольких тысяч аминокислот с относительной молекулярной массой свыше 10 000. СТРУКТУРА БЕЛКОВ Какова же структура белка? Каждому белку в определенной среде свойственна особая пространственная структура. При характеристике пространственной (трехмерной) структуры выделяют четыре уровня организации молекул белков. Первичная структура — последовательность аминокислот в полипептидной цепи. Такая структура специфична для каждого белка и определяется генетической информацией, т. е. зависит от последовательности нуклеотидов в участке молекулы ДНК, кодирующем данный белок. От первичной структуры зависят все свойства и функции белков. Замена одной-единственной аминокислоты в составе молекул белка или нарушение порядка в их расположении обычно влечет за собой изменение функции белка. Постулаты (принципы формирования пептидной связи), сформулированные Л. Поллингом и Р. Кори: 1) атомы, образующие пептидную связь, копланарны (расположены в одной плоскости); вращение атомов или групп атомов вокруг пептидной связи невозможно; 2) принцип эквивалентности вклада АК-остатков в образование пептидной связи и, тем самым, в образование полипептидной цепи (исключение пролин); 3) принцип максимума водородных связей. Первичную структуру белка стабилизируют (поддерживают): пептидные связи (между АК-остатками); дисульфидные связи (между свободными –SH-группами цистеина). Первичная структура белка несет информацию о его пространственной структуре. Первичная структура — ковалентно связанные мономеры в полимер.
Рисунок - Аминокислотная последовательность белка рибонуклеазы (124 аминокислотных звена) В живых клетках молекулы белков или отдельные их участки представляют собой не вытянутую цепь, а скручены в спираль, напоминающую растянутую пружину (это так называемая а-спираль), или сложены в складчатый слой (р-слой). Такие α -спирали и р-слои являются вторичной структурой. Вторичная структура белка — локальная конформация, обусловленная вращением отдельных участков полипептидной цепи вокруг одинарных ковалентных связей. Она возникает в результате образования водородных связей внутри одной полипептидной цепи (спиральная конфигурация) или между двумя полипептидными цепями (складчатые слои).
Вторичная структура — полипептидная цепь закручена в виде спирали, локальные упорядоченные структуры полимера - полностью α -спиральную конфигурацию имеет белок кератин. Это структурный белок волос, ногтей, когтей, клюва, перьев и рогов; он входит в состав наружного слоя кожи позвоночных. Третичная структура белка — это расположение в пространстве всей полипептидной цепи, отдельные участки которой имеют собственную локальную конформацию. Третичная структура белка – - миоглобина - полная укладка в пространстве одной цепи полимера. Поддержанию третичной структуры белка способствуют гидрофобные связи, которые образуются внутри молекулы. В образовании этих связей принимают участие неполярные радикалы аминокислот. Могут также образовываться другие нековалентные связи. У большинства белков спиральные и неспиральные участки полипептидной цепи складываются в трехмерное образование шаровидной формы — глобулу (характерна для глобулярных белков). Глобула определенной конфигурации является третичной структурой белка. Такая структура стабилизируется ионными, водородными, ковалентными дисульфидными связями (образуются между атомами серы, входящими в состав цистеина, цистина и мегионина), а также гидрофобными взаимодействиями. Наиболее важными в возникновении третичной структуры являются гидрофобные взаимодействия; белок при этом свертывается таким образом, что его гидрофобные боковые цепи скрыты внутри молекулы, т. е. защищены от соприкосновения с водой, а гидрофильные боковые цепи, наоборот, выставлены наружу. Четвертичная структура формируется при объединении нескольких полипептидных цепей, имеющих третичную структуру. Образованный таким образом белок обладает новой функцией. Четвертичная структура — гемоглобина – укладка субъединиц в пространстве. Белки с четвертичной структурой называются олигомерными, а составляющие их индивидуальные полипептидные цепи — протомерами или мономерами. Такие соединения стабилизируются водородными связями и электростатическими взаимодействиями между АК-остатками, расположенными на поверхности протомеров. Преимущества белков с четвертичной структурой: 1) экономия генетического материала; 2) уменьшение числа ошибок при синтезе белка; 3) качественное разнообразие белков — появление у белков новых функций. Многие белки с особо сложным строением состоят из нескольких полипептидных цепей (субъединиц), образуя четвертичную структуру белковой молекулы. Такая структура имеется, например, у глобулярного белка гемоглобина. Его молекула состоит из четырех отдельных полипептидных субъединиц (протомеров), находящихся в третичной структуре, и небелковой части — гема. Только в такой структуре гемоглобин способен выполнять свою транспортную функцию.
|


 Молекулы аминокислоты цистеина HS – CH2 – CH – COOH
Молекулы аминокислоты цистеина HS – CH2 – CH – COOH

 1 По числу аминокислотных остатков:
1 По числу аминокислотных остатков: