Занятие 1.1.4
Сольватирование частиц растворенного вещества является процессом_____.
1) Эндотермическим 3) Экзотермическим
2) Физическим 4) Необратимым
ТЕМА: Протолитические реакции. Буферные растворы. ЦЕЛЬ: Познакомиться с основами протолитических процессов, протекающих в организме человека, усвоить природу протолитического гомеостаза и возможные причины его нарушения. ЗНАТЬ: 1. Основные положения протолитической теории кислот и оснований. Кислоты и основания по Бренстеду-Лоури, сопряженные кислоты и основания. Константы кислотности и основности. Показатели кислотности (рКа) и основности (рКb). Связь между константой кислотности и константой основности в сопряжённой протолитической паре. 2. Диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели, рН биологических жидкостей. 3. Изменение рН органов и тканей при различных заболеваниях. Ацидоз. Алкалоз. Способы их устранения. 4. Гидролиз солей. Степень и константа гидролиза. Амфолиты. Изоэлектрическая точка. 5. Буферные системы. Механизм буферного действия систем I и II типа. Расчет рН буферных систем при добавлении сильной кислоты или сильного основания. 6. Буферное действие. Буферная ёмкость. Расчет буферной ёмкости по кислоте и по основанию. Факторы влияющие на буферную ёмкость. 7. Буферные системы крови. Сравнительная буферная емкость буферных систем крови. Бикарбонатная, фосфатная, белковая, гемоглобиновая буферные системы. Механизм действия. Формулы для расчета. 8. Применение реакции нейтрализации в фармакотерапии. УМЕТЬ: 1. Самостоятельно пользоваться учебной, научной и справочной литературой. 2. Пользоваться химической посудой (бюретки, пипетки, конические колбы и т.д.). 3. Готовить буферные смеси с определёнными значениями рН среды и определять буферную ёмкость методом титрования. 5. Рассчитывать рН и рОН сильных (слабых) электролитов и буферных систем. ВЛАДЕТЬ: 1. Навыками самостоятельной работы с учебной и справочной литературой. 2. Навыками приготовления буферных смесей. 3. Навыками оформления результатов и выводов экспериментальных работ.
Лабораторная работа №3 «Свойства буферных растворов» Основные уравнения по теме: «Протолитические реакции. Буферные растворы» 1. рKa = -lgKa - показатель константы кислотности 2. рKb =-lgKb - показатель константы основности 3. рH = -lg [H+] - водородный показатель среды 4. pOH = -lg [OH-] - гидроксильный показатель среды 5. [H+]× [OH-] = 1× 10-14 - ионное произведение воды pH + pOH = 14 6. 7. рH = 1/2 [pKa - lgC(1/z кислоты)] - расчет рН для растворов слабых кислот 8. pH = 14-1/2 [pKb - lgC(1/z основания)] - расчет рН для растворов слабых оснований
9.
10. 11.
12. 13. 14. 15. 16. 17.
18. 19. HHb + O2 + HCO3- = HbO2- + H2CO3 - суммарный процесс, протекающий в легочных капиллярах
20. HbO2- + H2CO3 = O2 + HHb + HCO3 - - суммарный процесс, протекающий в тканевых капиллярах
|

 - закон разведения Оствальда
- закон разведения Оствальда - расчёт константы гидролиза соли слабой кислоты и сильного основания
- расчёт константы гидролиза соли слабой кислоты и сильного основания - расчёт константы гидролиза соли слабого основания и сильной кислоты
- расчёт константы гидролиза соли слабого основания и сильной кислоты ,
,  ,
,  - степень гидролиза соли
- степень гидролиза соли - расчёт рН раствора соли, гидролизующейся по катиону
- расчёт рН раствора соли, гидролизующейся по катиону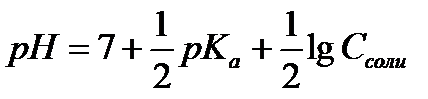 - расчёт рН раствора соли, гидролизующейся по аниону
- расчёт рН раствора соли, гидролизующейся по аниону - расчет рН для буферных систем I типа
- расчет рН для буферных систем I типа - расчет рН для буферных систем II типа
- расчет рН для буферных систем II типа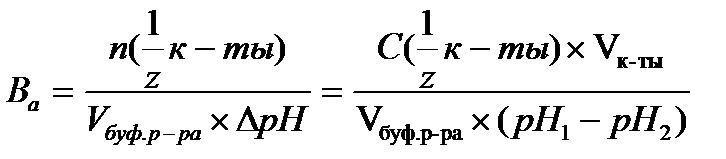 - определение буферной емкости по кислоте
- определение буферной емкости по кислоте - определение буферной емкости по основанию
- определение буферной емкости по основанию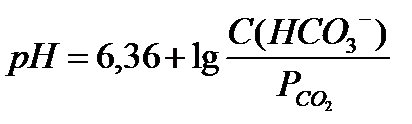 - уравнение Гендерсона-Гассельбаха для бикарбонатной буферной системы
- уравнение Гендерсона-Гассельбаха для бикарбонатной буферной системы


