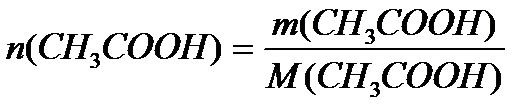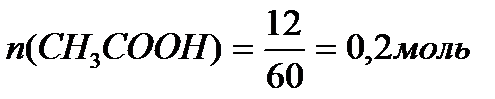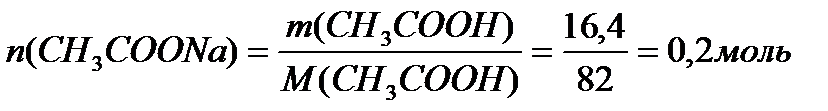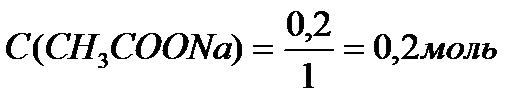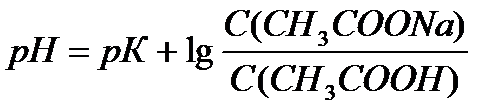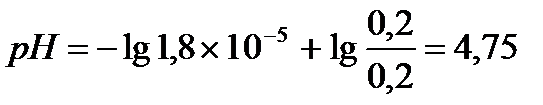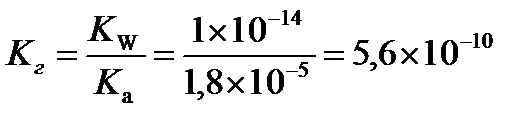Обучающие задачи. ?вет: слюна [H+] = 1,59∙´10-7моль/л, желудочный сок [H+] = 3,16´10-2 моль/л, кровь [H+] = 4´10 -8 моль/л. ? = 1/2 [pKa - lgC(CH3COOH)]; pH = 1/2 [4,75 - lg 0,001] = 1/2∙´ 7,75 = 3,875
Задача 1. Биологические жидкости имеют следующие значения рН: слюна 6, 8; желудочный сок 1, 5; кровь 7, 4. Рассчитайте концентрацию ионов водорода в каждой из указанных жидкостей. Решение: рН= - lg [H+], lg [H+] = - pH а) слюна рН = 6, 8, отсюда lg [H+] = -6, 8 [H+]=10-6, 8=1, 59∙ ´ 10 -7 моль/л б) желудочный сок рН = 1, 5 рН= - lg [H+], lg [H+] = - pH, отсюда lg [H+] = - 1, 5 [H+]=10-1, 5=3, 16∙ ´ 10 -2 моль/л в) кровь рН = 7, 4 рН= - lg [H+], lg [H+] = - pH отсюда lg [H+] = -7, 4 [H+]=10-7, 4 = 4, 0´ 10 -8 моль/л Ответ: слюна [H+] = 1, 59∙ ´ 10-7моль/л, желудочный сок [H+] = 3, 16´ 10-2 моль/л, кровь [H+] = 4´ 10 -8 моль/л. Задача 2. Вычислите степень диссоциации уксусной кислоты в растворе с молярной концентрацией эквивалента 0, 001 моль/л. Ка (СН3СООН) = 1, 8´ 10-5. Найти концентрацию ионов водорода и рН данного раствора. Решение: рН = 1/2 [pKa - lgC(CH3COOH)]; pH = 1/2 [4, 75 - lg 0, 001] = 1/2∙ ´ 7, 75 = 3, 875 [H+] = 10-pH = 10-3, 875 = 1, 35 × 10 -4; [H+] = 1, 35´ 10-4 моль/л.
Ответ: [H+] = 1, 35 ´ 10-4 моль/л, рН = 3, 875, α = 13, 5%. Задача 3. В клинических и биохимических лабораториях применяется ацетатный буфер, который содержит уксусную кислоту 12 г/л и ацетат натрия 16, 4 г/л. Определите концентрацию в моль/л уксусной кислоты и ацетата натрия, рН буферного раствора, зону буферного действия. (Ка (СН3СООН) = 1, 8 ´ 10-5). Решение:
M (CH3COOH) = 12+3+12+32+1 = 60 г/моль
M (CH3COONa) = 12+3+12+32+23 = 82 г/моль.
Ответ: С(CH3COOH)=0, 2 моль/л, С(CH3COONa) =0, 2 моль/л, pH = 4, 75, зона буферного действия 4, 75 ±1 Задача 4. Напишите уравнения гидролиза: CuCl2, Na2SO3, Cr2S3, NaCl, тристеарид, глицил-глицин, этилэтаноат, АТФ. Решение: CuCl2 – растворимая в воде соль, образована катионом слабого основания и анионом сильной кислоты, подвергается гидролизу. Гидролиз протекает по катиону слабого основания, рН< 7. При обычных условиях гидролиз протекает преимущественно по I ступени. CuCl2 = Cu2+ + 2Cl- Cu2+ +HOH ↔ CuOH+ + H+ CuCl2 + HOH ↔ CuOHCl + HCl Na2SO3 – растворимая в воде соль, образована катионом сильного основания и анионом слабой кислоты, подвергается гидролизу. Гидролиз протекает по аниону слабой кислоты, рН> 7. Na2SO3 = 2Na+ + SO32- SO32- + HOH ↔ HSO3- + OH- Na2SO3 + HOH ↔ NaHSO3 + NaOH Cr2S3 – соль, образованная слабым нерастворимым в воде основанием и слабой летучей кислотой. В водном растворе соль не существует, так как подвергается полному гидролизу: Cr2S3 + 6HOH = 2Cr(OH)3↓ + 3H2S↑ NaCl – растворимая в воде соль, образована катионом сильного основания и анионом сильной кислоты. Гидролизу не подвергается. Тристеарид – это жир, образованный многоатомным спиртом глицерином и стеариновой кислотой, эти вещества и получаются при гидролизе: CH2-O-CO-C17H35 CH2-OH | | CH-O-CO-C17H35 + 3H2O ↔ CH-OH + 3C17H35COOH | | CH2-O-CO-C17H35 CH2-OH Глицилглицин – дипептид, при его гидролизе происходит разрыв пептидной связи NH2-CH2-CO-NH-CH2-COOH + H2O ↔ NH2-CH2-COOH + NH2-CH2-COOH Этилэтаноат – сложный эфир, при гидролизе которого образуются спирт и карбоновая кислота. СH3COOC2H5 + HOH ↔ CH3COOH + C2H5OH Аденозинтрифосфат (АТФ) – главный источник энергии для многих биологических процессов – биосинтеза белка, ионного транспорта, сокращения мышц, электрической активности нервных клеток. Гидролиз АТФ записывают в виде кислотно-основного равновесия: АТФ4- + HOH ↔ АДФ3- + HPO42- + H+, ∆ G0=-30, 5кДж/моль Задача 5. Определить рН раствора, константу и степень гидролиза ацетата калия, если молярная концентрация соли равна 0, 1 моль/л, а Kа(СН3СООН)=1, 8× 10-5. Решение: Уравнение гидролиза СН3СООК + НОН ↔ СН3СООН + КОН СН3СОО- + НОН ↔ СН3СООН + ОН- Вычислим константу гидролиза
Рассчитаем степень гидролиза
Определяем концентрацию гидроксид-ионов в растворе и рОН С(ОН-)= h× Cсоли = 7, 5× 10-5× 0, 1 = 7, 5× 10-6 (моль/л) рOН = -lg[OH-] = -lg7, 5× 10-6 = 5, 12 pH = 14 – pOH = 14 – 5, 12 = 8, 88 Ответ: рН = 8, 88, Кг = 5, 6× 10-10, h = 7, 5× 10-5
З адачи для самостоятельной работы Задача 6. Определите рН буферного раствора, который получен смешиванием 0, 1 моль/л раствора NH4Cl и 0, 1 моль/л раствора NH4OH в соотношении: а) = 1: 1, б) 1: 4, в) 4: 1. К (NH4OH) = 1, 79´ 10 - 5 Ответ: а) рН = 9, 26, б) рН = 9, 86, в) рН= 8, 66. Задача 7. Вычислите массу ацетата натрия, которою следует добавить к раствору уксусной кислоты С(СН3СООН) = 0, 316 моль/л и объемом 2 л, чтобы получить буферный раствор с рН= 4, 87. Ответ: 68, 4 г Задача 8. Сколько молей эквивалента аскорбиновой кислоты необходимо ввести больному для нормализации крови при алкалозе, если рН его крови 7, 65 (норма 7, 45) общее количество крови 5л, буферная емкость по кислоте 0, 05 моль/л. Ответ: 0, 05 моль - эквивалента. Задача 9.? Буферная емкость по кислоте 0, 05 моль/л, рассчитайте, какой объем хлороводородной кислоты концентрацией 0, 1 моль/л необходимо добавить к 1л крови, чтобы уменьшить её рН с 7, 35 до 7, 1? Ответ: 0, 125 литра Задача 10. Напишите по стадиям уравнения реакций гидролиза следующих солей: FeCl3, CuSO4. На основании чего можно утверждать, что последняя стадия реакции гидролиза этих солей не происходит. Тестовые вопросы 1. Сокращенное молекулярно-ионное уравнение Ва+2+SO42-=BaSO4 соответствует реакции: 1) Ba(NO3)2+SO2® 2) BaCO3+H2SO4® 3) BaCl2+Na2SO4® 4) Ba3(PO4)2+H2SO4®
|

 или
или 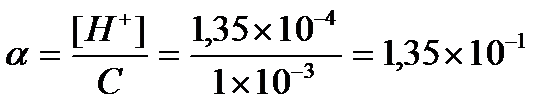 или 13, 5%
или 13, 5%