Некоторых веществ
Согласно статистической термодинамике, энтропия является мерой беспорядка. М. Планк предложил постулат: энтропия правильно сформированного твердого тела при абсолютном нуле равна нулю. Это формулировка третьего закона термодинамики. При температуре Т =0 К все вещества находятся в твердом состоянии, а кристалл с идеальной упорядоченностью должен иметь В соответствии с третьим законом термодинамики абсолютная энтропия индивидуального вещества при температуре Т К определяется по формуле:
На пути перехода кристаллического вещества от 0 до Т встречаются фазовые переходы кристалл – жидкость и жидкость – газ. Энтропия фазовых переходов учитывается при вычислении абсолютного значения энтропий. Пример. Для получения негашеной извести используют минерал СаСО3. Определим температуру разложения карбоната кальция. Считаем, что процесс идет про постоянном давлении р = 1 атм (давление углекислого газа). СаСО3(т) ® СаО(т) + СО2(г); Для расчета температуры разложения СаСО3 воспользуемся функцией Гиббса D rG 0 = D rН 0 – Т D rS 0 и рассчитаем
делая допущение, что D rН 0 и D rS 0 не зависят от температуры. Величины
Находим температуру разложения СаСО3, при которой достигается термодинамическое равновесие, т. е.
Выше 833 0С реакция разложения карбоната кальция с образованием углекислого газа и оксида кальция (негашеной извести) термодинамически разрешена.
|

 , кДж/моль
, кДж/моль
 , Дж/моль К
, Дж/моль К
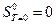 .
.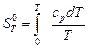 . (4.39)
. (4.39) =?
=? – Т×
– Т×  ,
, или» 833 0С.
или» 833 0С.


