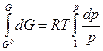Термодинамический взгляд на химическое равновесие. Химический потенциал индивидуального соединения
Рассмотрим обратимую химическую реакцию nА А + nВ В ⇄ nС С + nD D, где ni – стехиометрические коэффициенты. Общее условие химического равновесия можно получить, используя химические потенциалы mА, mВ, mС, mD участников процесса. Выведем уравнение, выражающее химический потенциал индивидуального соединения. В основном химические процессы проводят в условиях, определяемых внешним давлением и температурой. В этом случае критерием направления процесса является функция Гиббса. G = f (p, T) или G = U + pV – TS. Полный дифференциал функции Гиббса dG = dU + pdV +Vdp – TdS – SdT. (4.40) Согласно первому и второму законам термодинамики dQ = dU + pdV и dQ= TdS. Отсюда следует обобщенное уравнение: dU + pdV= TdS или dU + pdV – TdS = 0. (4.41) Подставляя уравнение (4.41) в (4.40), получаем: dG = Vdp – SdT. (4.42) При р = const уравнение (4.42) преобразуется в dG = – SdT или а при Т = const dG = Vdp или Для одного моль (n = 1) чистого газообразного вещества, проявляющего свойства идеального газа,
Комбинируя уравнения (4.44) и (4.45), получим при T = const
Интегрирование последнего уравнения в пределах от р = 1 атм до р приводит к уравнению, выражающему зависимость химического потенциала от температуры и давления.
G = G 0 + RT ln p или m = m 0 + RT ln p. Функция Гиббса, рассчитанная на моль индивидуального вещества, есть мольный химический потенциал индивидуального вещества.
|

 , (4.43)
, (4.43) . (4.44)
. (4.44) . (4.45)
. (4.45) .
.