Константа растворимости
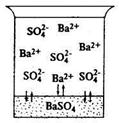
Рассмотрим процессы, возникающие при взаимодействии малорастворимого, но сильного электролита BaSO4 с водой. Под действием диполей воды ионы Ва2+ и SO2-4 из кристаллической решетки будут переходить в жидкую фазу. Одновременно с этим процессом под влиянием электростатического поля кристаллической решетки часть ионов Ва2+ и SO2-4 вновь будет осаждаться (рис. 5.1). При данной температуре в гетерогенной системе наконец установится равновесие: скорость процесса растворения (v 1) будет равна скорости процесса осаждения (v2) т.е. v 1 = v2: BaSO4 ↔ Ва2+ + SO2-4 Твердая фаза Раствор
Рис. 5.1. Процессы в насыщенном растворе сульфата бария
Раствор, находящийся в равновесии с твердой фазой BaSO4, называется насыщенным относительно сульфата бария. Насыщенный раствор представляет собой равновесную гетерогенную систему, которая характеризуется константой химического равновесия:
Kх.р = a(Ba2+) • a(SO42 - ), (5.1) a(BaSO4)
где: а(Ва2+) - активность ионов бария; а(SO2-4) - активность сульфат-ионов; a(BaSO4) - активность сульфата бария. Знаменатель этой дроби - активность кристаллического BaSO4 - является постоянной величиной, равной единице. Произведение двух констант дает новую постоянную величину, которую называют термодинамической константной растворимости и обозначают К0s: К0s = а(Ва2+) • а(SO2-4). (5.2)
Эту величину раньше называли произведением растворимости и обозначали ПР. Таким образом, в насыщенном растворе малорастворимого сильного электролита произведение равновесных активностей его ионов есть величина постоянная при данной температуре. Если принять, что в насыщенном растворе малорастворимого электролита коэффициент активности f ≈ 1, то активность ионов в таком случае можно заменить их концентрациями, так как а(Х) = f(X) • С(Х). Термодинамическая константа растворимости К0s перейдет в концентрационную константу растворимости Кs: Ks= C(Ba2+) • C(SO2-4), (5.3)
где С(Ва2+) и C(SO2-4) - равновесные концентрации ионов Ва2+ и SO2-4 (моль/л) в насыщенном растворе малорастворимого сильного электролита сульфата бария. Для упрощения расчетов обычно пользуются концентрационной константой растворимости Ks, принимая f (X) = 1. Если малорастворимый сильный электролит образует при диссоциации несколько ионов, то в выражение Кs (или К0s) входят соответствующие степени, равные стехиометрическим коэффициентам:
РbС12 ↔ Рb2+ +2С1-; Кs = С(Рb2+) • С2(С1-);
Ag3PO4↔ 3Ag+ + PO3-4 Кs = С3(Ag+) • С(PO3-4).
В общем виде значение концентрационной константы растворимости для электролита АтВп имеет вид Ks = Cm(An+) • Сп(Вт-). (5.4)
Величиной Кs принято пользоваться только в отношении электролитов, растворимость которых в воде не превышает 0, 01 моль/л.
|