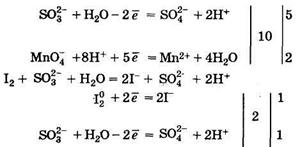Проба 1: SO2-3 + НОН ↔ НSO2-3 + ОН- .
Проба 2: SO2-3 + Ва2+ = BaSO3↓;
BaSO3 + 2Н+ = Ва2+ + SO2↑ + Н2О.
Проба 3: SO2-3 + 2Н+ = SO2↑ + Н2О.
Проба 4: 5SO2-3 + 2MnO-4 +6H+ = 5SO2-3 + 2Mn2+ + 3H2O.
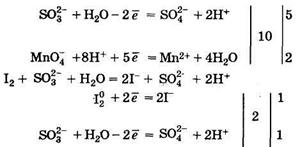
Таблица 15.1 Результаты качественного анализа растворов, содержащих анионы
| Номер
| Реагент
| Раствор 1
| Раствор 2
| Раствор 3
| Раствор 4
| Раствор 5
| Раствор 6
| Раствор 7
| Раствор 8
| Раствор 9
|
| реагента
|
| бесцветный
| бесцветный
| бесцветный
| бесцветный
| бесцветный
| бесцветный
| бесцветный
| бесцветный
| бесцветный
|
|
| ВаС12в нейтральной или слабощелочной среде
| Осадка нет
| Осадка нет
| Осадка нет
| Осадка нет
| Белый оса док, растворяется в НСl с бурным выделением газа
| Белый осадок, не растворяется в кислотах
| Белый осадок, растворяется в кислотах без выделения газа
| Осадка нет
| Осадка нет
|
|
| AgNO3B присутствии HNO3
| Белый оса док, растворяется в HN4OH
| Желтовато белый осадок, плохо - растворяется в NH4OH
| Желтый осадок, не растворяется в NH4OH
| Черный осадок
| В среде HNO3 осадок не выпадает
| Осадка нет
| В среде HNO3 осадка нет
| Тоже
| Тоже
|
|
| КМnО, в присутствии H2SO4
| КМnО4 частично обесцвечивается при нагревании
| КМnО4 обесцвечивается
| Окраска КМnО4 исчезает, раствор становится коричневым
| КМnО4 обесцвечивается, в растворе белая муть
| КМnО4 не обесцвечивается
| КМnО4 не обесцвечивается
| КМnО4 не обесцвечивается
| КМnО4 не обесцвечивается
| КМnО4 обесцвечивается
|
|
| Характерная реакция открытия иона
| При обработке аммиачного раствора серебряной соли (см. реагент 2)азот ной кислотой - белый осадок
| С хлорной водой -слой органического раствори теля желтый
| С хлорной водой -слой органического растворителя розово -фиолетовый
| С H2SO4 вы деление бесцветного газа с запахом тухлых яиц
| С H2SO4 бурное выделение бесцветного газа без запаха
| См. реагент 1
| С AgNO3 желтый осадок, растворяется в HNO3 и NH4OH
| С дифениламином интенсивно-синее окрашивание
| С H2SO4 -выделение бурого газа
|
ГЛАВА 16. АНАЛИЗ НЕОРГАНИЧЕСКОГО