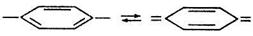Кислотно-основные индикаторы
Индикаторы кислотно-основного титрования - это сложные органические вещества, которые способны изменять свою окраску в зависимости от рН раствора. Известно около 200 кислотно-основных индикаторов, относящихся к различным классам органических соединений. Наиболее широкое распространение получили индикаторы группы трифенилметана (фенолфталеин, тимолфталеин, феноловый красный, кристаллический фиолетовый и др.) и группы азосоединений (метилоранж, метиловый красный и др.). Кроме индивидуальных, для титрования часто применяют смешанные индикаторы, представляющие собой смеси двух, трех или более индикаторов, которые дают более четкие переходы окраски при изменении рН растворов. Механизм изменения окраски индикаторов при изменении кислотности среды обычно рассматривается с позиций ионной и хромофорной теорий. Согласно ионной (протолитической) теории, кислотно-основные индикаторы представляют собой слабые органические кислоты HInd или основания IndOH, которые растворах могут существовать в ионизированной и не-ионизированной формах. Эти формы окрашены в разный цвет и находятся в равновесии, зависящем от рН среды. Например, свойства кислотных индикаторов характеризуются следующим равновесием:
Изменение кислотности раствора приводит к смещению равновесия диссоциации либо вправо (увеличение рН), либо влево (уменьшение рН). Это сопровождается изменением соотношения молекулярной и ионной форм индикатора и, следовательно, изменением окраски раствора. Хромофорная теория кислотно-основных индикаторов связывает изменение их окраски с изменением строения индикаторов в результате внутримолекулярной перегруппировки. Свое название эта теория получила от того, что окраска органических соединений приписывается наличию в них особых атомных групп (обычно содержащих кратные связи), называемых хромофорами. К хромофорам относятся нитрогруппа
способная превращаться в группу НО – N =, азогруппа -N = N –, переходящая при определенных условиях в группу = N – NH –, несколько близко расположенных друг к другу карбонильных групп > С = О или двойных связей и т.п. Очень важным хромофором является хиноидная система, которая может в определенных условиях образоваться из бензольной по следующей схеме:
Вызванная хромофорами окраска соединения усиливается присутствием в молекуле групп, называемых ауксохромами. Важнейшими ауксохромами являются группы -ОН и -NH2, а также их производные, содержащие различные радикалы, например группы - ОСН3, - N(CH3)2, - N(C2H5)2 и т.д. В отличие от хромофоров ауксохромы сами по себе не способны придавать окраску соединению, но, присутствуя совместно с хромофорами, они усиливают действие последних. Согласно хромофорной теории изменение окраски индикаторов происходит в результате внутримолекулярной перегруппировки. Если при этом в индикаторе возникают (или исчезают) группы (хромофоры, ауксохромы), то окраска индикатора изменяется. Следует отметить, что превращение изомерных форм друг в друга у индикаторов - процесс обратимый. Обратимая изомерия называется таутомерией, а соответствующие изомеры - таутомерами. В растворе любого кислотно-основного индикатора согласно хромофорной теории присутствуют его различные таутомерные формы, которые находятся в равновесии друг с другом и обладают разной окраской. Ионная и хромофорная теории совершенно различно освещают процессы, происходящие с индикаторами. Однако они не исключают, а, наоборот, очень удачно дополняют друг друга, так как ионизация молекул индикатора обычно предшествует внутримолекулярной перегруппировке. В качестве примера рассмотрим механизм изменения окраски метилоранжа при переходе от кислой к щелочной среде. Молекулы метилоранжа содержат одновременно кислотную -SO3H и основную -N(CH3)2 группы. При диссоциации метилоранжа образуется диполярный ион розового цвета из-за присутствия хромофора - хиноидной системы:
Этот ион устойчив в кислой среде, а при подщелачивании раствора изменяет свое строение, что сопровождается переходом розовой окраски в желтую вследствие изменения хиноидной системы и появления нового хромофора - азо-группы: окраску индикатора, обусловленную обоими хромофорами, усиливает присутствие ауксохрома -N(CH3)2.
При изменении рН раствора все кислотно-основные индикаторы изменяют свою окраску не скачкообразно, а плавно, т.е. в определенном интервале значений рН, называемом интервалом перехода окраски индикатора ∆ рН. Каждый индикатор имеет свой интервал перехода, который зависит от особенностей структуры индикатора и его способности к ионизации. Интервал перехода окраски индикатора определяется выражением ∆ рН = рК±1, (20.1)
где рК - показатель константы ионизации (диссоциации) слабокислотного или слабоосновного индикатора. Для большинства кислотно-основных индикаторов интервал перехода окраски составляет примерно 2 ед. рН: от рН1 = рК - 1 до рН2 = рК + 1. Кроме интервала перехода окраски, индикаторы характеризуют показателем титрования рТ. Показатель титрования рТ - это значение рН в пределах интервала перехода окраски, при котором наблюдается наиболее резкое изменение цвета индикатора и заканчивается титрование. Показатель титрования pTобычно равен рН раствора, при котором концентрации обоих окрашенных форм индикатора равны, т.е. [HInd] = [Ind-] и тогда соблюдается равенство: рТ = рН = рК. В химических справочниках обычно указываются окраски кислотной и основной форм индикатора, значения интервала перехода окраски и методика приготовления раствора индикатора. Например, интервал перехода окраски индикатора метилоранжа (метиловый оранжевый) находится в пределах рН от 3, 1 до 4, 4. При рН > 4, 4 метилоранж - желтый, при рН < 3, 1 - розовый (см. табл. 2.1), в интервале от рН 3, 1 до рН 4, 4 окраска его постепенно изменяется из розовой в желтую. Показатель титрования метилоранжа равен 4, 0. Другой индикатор - фенолфталеин - при рН < 8 бесцветный, в интервале рН от 8, 0 до 10, 0 окраска из бледно-розовой постепенно переходит в ярко-малиновую. Показатель титрования для фенолфталеина равен 9. Интервал перехода окраски индикатора метилового красного от рН 4, 4 до рН 6, 2. При рН < 4, 4 этот индикатор имеет красный цвет, при рН > 6, 2 - желтый. Показатель титрования для этого индикатора равен 5. Индикаторы применяют либо в виде растворов, несколько капель которых добавляют к испытуемому раствору, либо в виде индикаторных реактивных бумаг, представляющих собой кусочки фильтровальной бумаги, пропитанные раствором индикатора и высушенные. При определении рН на индикаторную бумагу наносят несколько капель испытуемого раствора и по окраске бумаги судят (приближенно) о его значении. Различные индикаторы изменяют свой цвет при разных значениях рН, что позволяет подобрать во всем диапазоне шкалы подходящий индикатор или индикаторную бумагу. Часто применяют универсальные индикаторы -смеси индикаторов, приобретающих различный цвет при нескольких значениях рН, что позволяет ориентировочно судить о его значении. Универсальные бумаги на обложке имеют сравнительную цветную шкалу значений рН.
|