Вопрос 1: Предельные углеводороды. Их строение и свойства. Основные направления промышленного использования метана
Ответ. Предельные (ненасыщенные) углеводороды, или алканы, - органические вещества с общей формулой CnH2n+2, в молекулах которых атомы углерода соединены между собой одинарной связью ( Представители алканов - этан C2H6. Молекулярная формула: C2H6. Графическая формула: CH3-CH3.
Номенклатура Построение названий алканов с разветвленной цепью. 1. Выбирают самую длинную цепочку атомов углерода. 2. Номеруют ее с того конца, к которому ближе стоит углеводородный радикал. 3. Цифрами указывают номера углеродных атомов, с которыми связаны радикалы. А приставками («ди-», «три-» и т.д.)-количество радикалов. 4. К названиям радикалов приписывают названия алкана. Которому соответствует длинная цепочка атомов углерода. Пример: 1 2 3 4 5 CH3-CH-CH-CH2-CH3. │ │ CH3CH3 2, 3-диметилпентан Изомерия углеродного скелета CH3-CH2-CH2-CH2-CH3, бутан CH3-CH(CH3)-CH3, С4H10 – брутто- формула. 2-метилпропан
Физические свойства C1- C4- газы, C5- C16- жидкости, C17 и более- твердые вещества, в воде нерастворимы, могут растворяться в органических растворителях. Температура кипения неразветвленных алканов выше, чем у разветвленных. Температура кипения тем выше, чем больше масса молекулы. Химические свойства 1. Окисление: а) горение: CH4+2O2=CO2
б) каталитическое окисление: CH4+O2 формальдегид 2. Дегидрирование: а) крекинг: 2CH4 б) разложение: CH4 3. Изомеризация: CH3-CH2-CH2-CH2-CH3 n- пентан 2- метилбутан
4. Замещение: а) нитрование(реакция Коновалова): CH4+HNO3 нитрометан б) замещение галогенами (происходит по свободнорадикальному механизму): CH4+Cl2 монохлорметан Под действием света молекула хлора распадается на два радикала Cl: Сl2 Реакционная способность этих радикалов обусловлена наличием у них неспаренного электрона, т.е. ненасыщенной валентности. Один радикал CH4+ Радикал
Радикал CH4+4Cl2 тетрахлор-метан
|

 – связь), а все остальные валентности насыщены атомами водорода.
– связь), а все остальные валентности насыщены атомами водорода.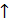 +2H2O+Q;
+2H2O+Q; CH2O+ H2O.
CH2O+ H2O.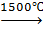 C2H2↑ + 3H2↑;
C2H2↑ + 3H2↑;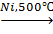 С+ 2H2↑.
С+ 2H2↑. CH3-CH(CH3)CH2-CH3.
CH3-CH(CH3)CH2-CH3. CH3NO2+H2O.
CH3NO2+H2O.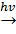 CH3Cl↑ +HCl↑.
CH3Cl↑ +HCl↑. .
. Взаимодействует с молекулой углеводорода, отрывая от неё
Взаимодействует с молекулой углеводорода, отрывая от неё  . При этом образуются химически активная частица- радикал
. При этом образуются химически активная частица- радикал  – и HCl:
– и HCl: →
→  + HCl.
+ HCl.


