Билет № 8
Вопрос 1 .Бензол.Его строение, свойства, получение и применение. Ответ. Бензол- простейший представитель класса ароматических углеводородов (аренов).
Арены – сложные органические вещества, в молекулах которые есть бензольное кольцо (ядро).
В молекуле бензола все связи между атомами углерода равноценны, это полуторные связи.
Физические свойства Бесцветная жидкость с характерным запахом, в воде не растворяется, легче воды, температура кипения 80 0С, температура плавления 5, 5 0С, хороший растворитель, ядовит.
Химические свойства 1.Горение (сильный коптящее пламя):
2C6H6 + 15O2=12CO2↑ + 6H2O.
Сходство с предельными углеводородами 2.Устойчив к действию окислителей, в обычных условиях не обесцвечивает раствор перманганта калия и бромную воду, не присоединяет галогеноводороды и воду. 3.Замещение атомов водорода протекает легче, чем у алканов:
а) нитрование: C6H6 + HNO3=C6H5NO2 + H2O; нитробензол
б)галогенирование: C6H6 + Br2=C6H5Br + HBr; бромбензол в)алкилирование:
C6H6 + C2H5CI этилбензол Сходства с непредельными углеводородами 4.Присоединение по углеродным связям протекает с большим трудом, так как ароматическая система устойчива:
а) гидрирование (П. Сабатье и Ж.Б.Сандеран, 1900 г.
C6H6 + 3H2 циклогексан
б) галогенирование: C6H6 + 3CI2 гексахлор-циклогексан
Получение 1.Дегидрирование циклопарафинов (Зелинский, 1912 г.):
C6H12
2.Дегидрирование алканов: C6H14
3.Тримеризация ацетилена: актив. уголь 3C2H2 C6H6. 600 °С Применение 1.Как исходный реагент при синтезе многих органических соединений(фенол, циклогексан, анилин и др.) 2.В производстве красителей (анилиновых и др.) 3.В производстве пестицидов и полимеров. 4.В синтезе фармацевтических препаратов. 5.При изготовлении взрывчатых веществ. 6.Как растворитель лаков. 7.Как добавка к моторному топливу (для повышения октанового числа). 8.Для получения душистых веществ. 9.При изготовлении капрона и фенолформальдегидных смол.
|

 C6H5C2H5 + H6CI.
C6H5C2H5 + H6CI. C6H12;
C6H12;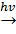 C6H6CI6.
C6H6CI6.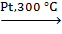 C6H6 + 3H2.
C6H6 + 3H2. C6H6 + 4H2.
C6H6 + 4H2.


