Вопрос 1. Ацетилен. Его строение, свойства, получение и применение
Ответ. Ацетилен относится к классу алкинов. Ацетеленовые углеводороды, или алкины, -непредельные (ненасыщенные) углеводороды с общей формулой Электронное строение Углерод в молекуле ацетилена находится в состоянии sp – гибридизации. Атомы углерода в этой молекуле образуют тройную связь, состоящую из двух -связей и одной σ -связи. Молекулярная формула: Графическая формула: H-C≡ C-H Физические свойства Газ, легче воздуха, малорастворим в воде, в чистом виде почти без запаха, бесцветный, Химические свойства 1. Горение:
2. Присоединение: а) водорода:
б) галогена: C2H2 + 2Cl2 = C2H2Cl4; 1, 1, 2, 2-тетрохлорэтан
в) галогеноводорода: HC≡ CH + HCl = винилхлорид
CH2=CHCl + HCl = CH3-CHCl2 1, 1-дихлорэтан (по правилу Марковникова); г) воды(реакция Кучерова): HC=CH + H2O = CH2=CH-OH виниловый спирт уксусный альдегид 3. Замещение: HC≡ CH + 2AgNO3 + 2NH4 = AgC≡ CAg↓ + 2NH4NO3 + 2H2O. ацетиленид серебра 4. Окисление: HC≡ CH + щавельная кислота 5. Тримеризация: 3HC≡ CH t, кат
бензол
6. Димеризация: HC≡ CH + HC≡ CH КАТ. HC≡ C - HC=CH2 винилацетилен Получение 1. Дегидрирование алканов (крекинг жидких нефтяных фракций): C2H6 = C2H2 + 2H2↑. 2. Из природного газа (термический крекинг метана):
2CH4 3. Карбидный способ:
CaC2 + 2H2O = Ca(OH)2 + C2H2↑
Применение 1.В производстве винилхлорида, ацетальдегида, винилацетата, хлоропрена, уксусной кислоты и других органических веществ. 2.В синтезе каучука и поливинилхлоридных смол. 3.В производстве поливинилхлорида (кожзаменитель). 4.В производстве лаков, лекарств. 5.При изготовлении взрывчатых веществ (ацетилениды).
|

 , в молекулах которых между атомами углерода есть тройная связь.
, в молекулах которых между атомами углерода есть тройная связь. .
. = - 83, 6
= - 83, 6  . (В ряду алкинов с увеличением молекулярной массы алкина температуры кипения и плавления увеличиваются.)
. (В ряду алкинов с увеличением молекулярной массы алкина температуры кипения и плавления увеличиваются.)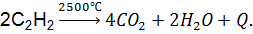


 CHCl
CHCl CH3-CHO
CH3-CHO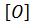 + H2O → HOOC-COOH (
+ H2O → HOOC-COOH ( -KMnO4).
-KMnO4). C2H2 + 3H2↑
C2H2 + 3H2↑


