Реакции нулевого порядка
В общем виде кинетическое уравнение реакции нулевого порядка выглядит следующим образом:
Скорость реакции постоянна и не зависит от концентрации реагирующих веществ. После интегрирования получаем: - c = k·τ + B, где В – постоянная интегрирования. При τ = 0 В = - с0. Тогда с = с0 - k·τ k = где с0, с – начальная концентрация исходного вещества и концентрация в момент времени τ от начала реакции. Константу скорости реакции нулевого порядка измеряют в моль/дм3·время. Если с = с0/2, то τ = τ 1/2. тогда k = или
где τ 1/2 - период полупревращения. Период полупревращения – это время, в течение которого в реакцию вступит половина исходного количества вещества. Для реакции нулевого порядка период полупревращения возрастает с увеличением начальной концентрации реагентов. Реакциями нулевого порядка, как правило, являются гетерогенные реакции, происходящие на поверхности.
|

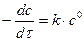 или – dc = k·dτ;.
или – dc = k·dτ;.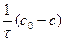 , (88)
, (88)
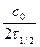
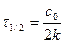 , (89)
, (89)


