Реакции третьего порядка
При равных начальных концентрациях реагентов в общем виде кинетическое уравнение реакции третьего порядка
После интегрирования получаем: 1/2 с2 = k · τ + В, где В – постоянная интегрирования. При τ = 0 В = 1/ с2 = 1/ с0 2 + 2 k · τ
Константу скорости реакции третьего порядка измеряют в дм6/(моль2·время). Период полупревращения
Для реакции третьего порядка период полупревращения обратно пропорционален квадрату начальной концентрации реагентов. Порядок реакции определяют несколькими способами, используя опытные данные об изменении концентрации реагирующих веществ со временем. 1. Метод подстановки. Экспериментально находят концентрацию одного из веществ через определённые промежутки времени от начала реакции. Подставляют найденные значения концентрации в уравнения (88), (90), (92), (94) и рассчитывают значения константы скорости. Уравнение, дающее одинаковые значения константы скорости в различные моменты времени, указывает на порядок реакции. 2. Графический метод. Из приведённых уравнений следует, что зависимость концентрации от времени для различных порядков может быть выражена прямой линией в соответствующей системе координат: с – τ (для n=0), ln с – τ (для n=1), 1/ с – τ (для n=2), 1/ с 2 – τ (для n=3). Отложив на оси абсцисс время τ, а на оси ординат – с, ln с, 1/ с, 1/ с 2, для изучаемой реакции получают четыре линии. Система координат, в которой экспериментальные данные лягут на прямую линию, укажет на порядок реакции, а тангенс угла наклона прямой к оси абсцисс равен константе скорости k (дляn=0, 1, 2) или 2 k (для n=3). 3. По периоду полупревращения. Период полупревращения для реакций различного порядка по-разному зависит от начальной концентрации реагентов (уравнения (89). (91), (93), (95)). Для реакции нулевого порядка τ 1/2 прямо пропорционален начальной концентрации с0, для реакции первого порядка – не зависит от начальной концентрации с0, для реакции второго порядка – обратно пропорционален с0, для реакции третьего порядка – обратно пропорционален с
|

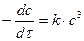 или – dc/с3 = k·dτ;.
или – dc/с3 = k·dτ;. . Тогда
. Тогда . (94)
. (94)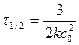 . (95)
. (95) . Проводят опыты с различными начальными концентрациями реагентов, находят τ 1/2 и делают вывод о порядке реакции.
. Проводят опыты с различными начальными концентрациями реагентов, находят τ 1/2 и делают вывод о порядке реакции.


