Лекция 17. Гидролиз солей. Степень и константа гидролиза
1. Типы гидролиза солей. 2. Факторы, влияющие на процесс гидролиза.
1. Типы гидролиза солей Гидролизом называют реакции взаимодействия веществ с водой, приводящие к образованию слабодиссоциирующих веществ: слабых кислот или оснований, кислых или основных солей. Результат гидролиза можно расценивать как нарушение равновесия диссоциации H2O. Рассмотрим процессы при растворении солей в воде. Соли, как правило, – сильные электролиты, поэтому происходит их полная диссоциация на ионы, которые, в свою очередь, могут взаимодействовать с ионами Н+ или ОН- воды. Следовательно, гидролиз солей протекает засчет взаимодействия ионов соли с водой. Этот процесс–частный случай реакций ионного обмена, когда в качестве реагента выступает вода. В зависимости от катионов и анионов соли можно разбить на ряд групп, различающихся между собой по характеру образующих эти соли кислот и оснований:
I. Соли слабой одноосновной кислоты и сильного однокислотного основания. Например, растворяется ацетат калия. Являясь сильным электролитом, он полностью диссоциирует на ионы, но вода также частично диссоциирует. Возможно возникновение следующего процесса:
+
CH3COOH Так как уксусная кислота – слабый электролит, то при столкновении ее кислотных остатков с ионами Н+ воды, образуются недиссоциированные молекулы уксусной кислоты. Удаление из раствора части ионов Н+ вызывает сдвиг равновесия процесса диссоциации воды слева направо. Содержание ионов ОН- в растворе нарастает. Раствор приобретает щелочную реакцию. В ионном виде процесс изображается уравнением:
В момент достижения равновесия применение закона действия масс приводит к выражению:
[H2O] в разбавленных растворах – величина постоянная, поэтому произведение К [H2O] – тоже константа. Ее называют константой гидролиза Кгидр:
Константу гидролиза можно выразить через ионное произведение воды и константу диссоциации кислоты. Для этого умножим числитель и знаменатель на [H+] и запишем:
В результате гидролиза число образующихся молекул слабой кислоты равно числу оставшихся от молекул воды несвязанных ионов [ОН-]: [ СН3СООН ] = [ ОН -] Концентрация ионов соли практически равна концентрации этой соли, так как сильные электролиты диссоциируют полностью: [ CH3COO -] = где Подставляем для Кгидр:
откуда [ OH -] = (Kгид р– Концентрация ионов гидроксила в растворе соли слабой одноосновной кислоты и сильного однокислотного основания равна квадратному корню из произведения константы гидролиза соли на ее концентрацию. Так как
В тех случаях, когда константа диссоциации кислоты очень мала, нельзя пренебрегать в расчете частью ее анионов, связавшейся в недиссоциированные молекулы. В этом случае расчет ведут по более точному выражению
откуда [OH-] = II. Соли сильной одноосновной кислоты и слабого однокислотного основания. Примером такой соли является хлорид аммония. Он сильный электролит и диссоциирует полностью NH4Cl → NH4+ + Cl- Вода также частично диссоциирует:
Столкновение ионов NH4+ с ионами ОН- приводит к образованию соединения NH4ОH, легко превращающееся в аммиак и воду.Общую схему процесса можно представить уравнением: NH4Cl → NH4+ + Cl- +
или в ионной форме
Связывание ионов ОН- из раствора вызывает сдвиг диссоциации воды слева направо. Концентрация ионов Н+ в растворе растет. Таким образом, гидролиз солей слабых однокислотных оснований и сильных одноосновных кислот создает кислую среду. Рассуждая аналогично I случаю, получим:
Подставим вместо [NH4ОH] равную ей концентрацию ионов [Н+], а вместо [NH4+] приближенно равную ей концентрацию соли Ссоль. Получим:
Если образующееся при гидролизе основание очень слабое, то расчет ведут по более точной формуле
III. Соли слабой одноосновной кислоты и слабого однокислотного основания. При растворении ацетата аммония в воде наступает его практически полная диссоциация: CH3COONH4 → NH4+ + CH3COO- Столкновение ионов NH4+ и СН3СОО- с молекулами воды приводит к образованию слабо диссоциирующих молекул соответственно слабого основания NH4ОH и слабой кислоты СН3СООН по схеме: CH3COOH → NH4+ + CH3COO- + +
NH4OH + CH3COOH Так как образующиеся вещества – слабые электролиты, то в результате соли слабых кислот и слабых оснований подвергаются почти полному гидролизу, а реакция среды в растворах определяется соотношением силы кислоты и основания. В ионной форме уравнение гидролиза соли может быть представлено уравнением:
Применим к нему закон действия масс для момента равновесия
Это выражение можно упростить. Умножим числитель и знаменатель на ионное произведение воды
Константы диссоциации основания и кислоты выражаются соответственно:
откуда следуют выражения для [NH4+] и [СНзСОО-]
Чтобы получить формулу для расчета [Н+], проведем ряд последовательных преобразований. Из уравнения: [ NH4 +] = [ CH3COO -]; [ CH3COOH ] = [ NH4OH ] Вместо [NH4ОH] подставим равную ей [СН3СООН], получим
Затем в константу диссоциации кислоты
введем вместо [СН3СОО-] равную ей [NН4+], получим:
Умножаем числитель и знаменатель соотношения на [Н+] и после сокращения [СН3СООН] и преобразований получим: [H+] = Из формулы видно, что концентрация ионов водорода в растворе соли слабой кислоты и слабого основания не зависит от концентрации раствора соли, а только от соотношения констант диссоциации кислоты и основания. IV. Соль сильного основания и сильной кислоты. Такая сольв растворе диссоциирует полностью, например хлорид калия KCl → K+ + Cl- В отличие от рассмотренных выше случаев ионы соли – сильного электролита – не могут образовать с водой слабых электролитов, а раз нет взаимодействия с водой, то, следовательно, соли сильных кислот и сильных оснований гидролизу не подвергаются. Среда в растворе остается нейтральной. 2. Факторы, влияющие на процесс гидролиза Соль слабого многокислотного основания и сильной одноосновной кислоты. Например раствор FeCI3 содержит только ионы, так как эта соль в растворе диссоциирует полностью: FeCl3 → Fe3+ + 3Cl- Катион соли представляет собой катион слабого основания, поэтому его столкновение с гидроксильными ионами воды приводит к образованию слабого электролита. Так как вода диссоциирует крайне незначительно, то столкновение ионов Fe3+ с тремя ионами ОН-невероятно, образование Fе(ОН)3 в результате гидролиза при обычных условиях невозможно. Очевидно, процесс взаимодействия ионов соли с молекулами воды должен протекать по стадиям FeCl3 → Fe3+ + 3Cl- +
(FeOH)2+ + H+ + 3Cl- (I стадия) Образовавшийся ион (FeOH)2+ может столкнуться еще с одним ионом ОН- (FeOH)2+ + H+ + 3Cl- +
[Fe(OH)2]+ + 2H+ + 3Cl- (II стадия) Возможность для осуществления различных этапов гидролиза не одинакова. Процессу гидролитического взаимодействия по I стадии ничто не препятствует, поэтому он протекает легко: Кр= 8, 9 ∙ 10-4, и в растворе накапливаются ионы Н+. Процесс электролитической диссоциации воды сдвигается справа налево. Концентрация ионов ОН- понижается. Вероятность столкновения ионов (FeOH)2+ с ионами ОН- в растворе становится незначительной, процесс по II стадии идет гораздо в меньшей степени: Кр =4, 9 ∙ 10-7. В итоге II стадии величина ОН- становится еще меньше, и третий этап гидролиза становится еще менее вероятным. Практически он самопроизвольно не осуществляется [Fe(OH)2]+ + 2H+ + 3Cl- +
Fe(OH)3 + 3H+ + 3Cl- (III стадия) Из уравнений всех трех этапов процесса видно, что ионы С1- участия в реакции не принимают, поэтому влияния на процесс гидролиза не оказывают. Гидролиз соли многокислотного основания и одноосновной кислоты имеет свои особенности. Процесс протекает по ступеням. При температуре, близкой к комнатной, гидролиз осуществляется практически только по I стадии вследствие накопления в растворе ионов Н+. Соли слабых многоосновных оснований и сильных кислот создают в растворе кислую среду. Соли слабых многоосновных кислот и сильных оснований. Рассуждая аналогично предыдущему случаю, можно записать для раствора К2СО3: K2CO3 → 2K+ + CO32- +
HCO3- (Iстадия) В результате I стадии гидролиза в растворе накапливаются ионы ОН-, подавляющие процесс диссоциации воды. Поэтому при нормальных условиях II стадия гидролиза становится мало вероятной:
2К+ + ОН- + НСО3- +
2К+ + 2ОН- + Н2СО3 (IIстадия) Таким образом, гидролиз солей слабых многоосновных кислот и сильных оснований протекает по стадиям и обычно заканчивается на первой. Раствор соли слабой многоосновной кислоты и сильного основания характеризуется щелочной средой. Соли слабой многоосновной кислоты и слабого миогокислотного основания. Рассуждаем аналогично предыдущим случаям. Для раствора А12(СО3)3 можно записать: Al2(CO3)3 → 2Al3+ + CO32- + +
AlOH2+ + HCO3- + Al3+ + 2CO32- Вторым этапом процесса будет связывание второго иона Al3+ в ион основной соли и еще одного иона СО32- в НСО3-. На I стадии процесса не происходит заметного накопления в растворе ионов ОН- и Н+. Поэтому II стадия гидролиза протекает беспрепятственно и оба процесса можно представить суммарным уравнением: Al2(CO3)3 → 2Al3+ + CO32- + +
2 AlOH2+ + 2HCO3- + CO32- И в результате II стадии не возникает заметного сдвига концентраций Н+ или ОН- в растворе, поэтому процесс диссоциации воды протекает беспрепятственно и обусловливает возможность течения следующих этапов гидролиза 2 AlOH2+ + 2HCO3- + CO32- + +
2 [Al(OH)2]+ + H2CO3 + 2HCO3- В результате этих стадий не возникло заметного изменения концентраций Н+ или ОН- в растворе, поэтому возможно продолжение гидролиза
2 [Al(OH)2]+ + H2CO3 + 2HCO3- + +
 2 H2O 2OH- + 2H+ (V и VI стадии) 2 H2O 2OH- + 2H+ (V и VI стадии)
2 Al(OH)3 + 3H2CO3 Таким образом, гидролиз солей слабых многоосновных кислот и слабых многокислотных оснований протекает сильнее, чем бинарных солей. В результате гидролиза могут образоваться продукты полного гидролиза соли. Стадия, до которой протекает гидролиз соли, определяется соотношением силы основания и кислоты. Для характеристики гидролиза различных солей вводятся две величины. Константа гидролиза Кгидр равна в момент динамического равновесия отношению произведения концентраций продуктов гидролиза к произведению концентраций гидролизующихся ионов соли. Степень гидролиза α гидр – отношение числа гидролизованных молекул соли к числу растворенных
Константы гидролиза соли растут по мере уменьшения констант диссоциации кислот и оснований, образующихся в результате процесса. Следовательно, возрастает и количество гидролизованных молекул. Степень гидролиза соли возрастает по мере уменьшения констант диссоциации кислот и оснований, образующихся в результате процесса. Пример 1. К раствору FeCl3 добавляют раствор К2СО3. Определить полноту гидролиза. Решение. Процесс гидролиза раствора FеС13 в сокращенной ионной форме изображается уравнением
Последующие стадии процесса не идут. В растворе К2СО3 гидролиз протекает по схеме
Таким образом, в результате гидролиза в растворах образуются в избытке противоположные по знаку ионы воды (Н+ и ОН-). При смешивании растворов FeCl3 и K2CO3 наступает взаимная нейтрализация ионов Н+ и ОН-. Затруднения для гидролиза по последующим стадиям исчезают, и гидролиз солей слабого основания и сильной кислоты в смеси с солью сильного основания и слабой кислоты идет до конца:
Образование осадка Fе(ОН)3 в результате полного гидролиза FеС13 и непрочной кислоты Н2СО3 облегчает течение процесса. Следовательно, добавление к раствору гидролизующейся соли другой соли, при гидролизе которой создается иная кислотность, усиливает процесс гидролиза. Разбавление раствора увеличивает вероятность столкновения ионов растворенного вещества с ионами воды, вследствие этого степень гидролиза растет. Константа гидролизаот разбавления раствора не зависит. При нагревании раствора увеличивается энергия теплового движения и вероятность столкновения ионов соли с ионами воды. Константа диссоциации воды и ее ионное произведение, а, следовательно, степень гидролиза и константа гидролиза растут. Так, процесс гидролиза раствора хлорида железа, протекающий при нормальной температуре до I стадии, при нагревании может проходить по II и даже по III. Это обусловлено увеличением количества ионов FeOH2+, образующихся в результате гидролиза FeCl3 и ростом концентрации ионов ОН- в растворе, вследствие увеличения ионного произведения воды. Процессы гидролиза могут быть усилены или подавлены добавлением соединений, содержащих ионы гидроксила или водорода или веществ, подвергающихся гидролизу. Пример 2. К раствору FеС13 добавляют NH4C1. Определить изменение процесса гидролиза. Решение. Процесс гидролиза FeCl3 запишется так:
При растворении NH4Cl осуществляется реакция
Прибавление хлорида аммония к раствору FeCl3 повышает концентрацию ионов Н+ в растворе. Равновесие смещается влево и гидролиз обеих солей снижается. Таким образом, добавление в раствор гидролизующейся соли другой соли, гидролиз которой сопровождается образованием ионов воды, аналогичных возникающим при гидролизе первой, подавляет гидролиз.
|


 CH3COOK K+ + CH3COO-
CH3COOK K+ + CH3COO- H2O OH- + H+
H2O OH- + H+
 СН3СОО- + Н2О СН3СООН + ОН-
СН3СОО- + Н2О СН3СООН + ОН- ,
,

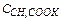
 – концентрация соли в растворе.
– концентрация соли в растворе.
 )1/2
)1/2 , то [OH-] = (
, то [OH-] = ( )1/2
)1/2 ,
, .
. H2O H+ + OH-
H2O H+ + OH-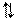
 H2O OH- + H+
H2O OH- + H+ NH4OH NH3 + H2O
NH4OH NH3 + H2O NH4+ + H2O [NH4OH] + H+
NH4+ + H2O [NH4OH] + H+ .
.
 .
.

 H2O OH- + H+
H2O OH- + H+ CH3COO- + NH4+ + H2O NH4OH + CH3COOH
CH3COO- + NH4+ + H2O NH4OH + CH3COOH
 .
. ;
; 
 ,
,  .
.



 H2O OH- + H+
H2O OH- + H+

 H2O OH- + H+
H2O OH- + H+

 H2O OH- + H+
H2O OH- + H+ H2O OH- + H+
H2O OH- + H+

 H2O OH- + H+ (I стадия)
H2O OH- + H+ (I стадия)
 2 H2O 2OH- + 2H+ (I и IIстадии)
2 H2O 2OH- + 2H+ (I и IIстадии)
 2 H2O 2OH- + 2H+ (III и IV стадии)
2 H2O 2OH- + 2H+ (III и IV стадии)


 Fe3+ + H2O FeOH2+ + H+
Fe3+ + H2O FeOH2+ + H+ FeOH2+ + H2O Fe(OH)2+ + H+
FeOH2+ + H2O Fe(OH)2+ + H+ Fe(OH)2 + H2O Fe(OH)3+ + H+
Fe(OH)2 + H2O Fe(OH)3+ + H+ HCO3- + H2O H2CO3 + OH-
HCO3- + H2O H2CO3 + OH- Fe3+ + H2O FeOH2+ + H+
Fe3+ + H2O FeOH2+ + H+


