Решение типовых задач. Задача 1. Гальванический элемент состоит из никелевого электрода, погруженного в 0,001М раствор NiSO4 и кадмиевого электрода
Задача 1. Гальванический элемент состоит из никелевого электрода, погруженного в 0, 001М раствор NiSO4 и кадмиевого электрода, погруженного в 0, 1М раствор CdSO4. Вычислите Э.Д.С. гальванического элемента, составьте схему, напишите уравнения электродных процессов. Решение. Так как электродные потенциалы металлов не являются стандартными (концентрации ионов металлов не равны 1 моль/л), определим электродные потенциалы по уравнению Нернста:
 ; ;
Кадмий в данном случае имеет меньший электродный потенциал и является анодом (А), никель имеет больший электродный потенциал и является катодом (К). Электродвижущая сила элемента: Е = φ (Ni2+/Ni) - φ (Cd2+/Cd) = -0, 337 - (-0, 433) = 0, 096 В. Уравнения электродных процессов: А(-) Сd0 - 2e → Cd2+ К(+) Ni2+ + 2e → Ni0. Схема гальванического элемента: А(-) Сd | CdSO4 || Ni | NiSO4 (+)K. Задача 2. Составьте схему, напишите электронные уравнения электродных процессов и вычислите Э.Д.С. гальванического элемента, в котором один хромовый электрод находится в 0, 02М растворе, а другой хромовый электрод - в 0, 001М растворе Cr2(SO4)3. Решение. Электродные потенциалы электродов равны:
Так как электродный потенциал хрома в 0, 001 М растворе меньше, чем в 0, 02М растворе, то схема данного гальванического элемента будет следующая: А(-) Сr | 0, 001M Cr2(SO4)3 || 0, 02M Cr2(SO4)3 | Сr (+)K Уравнения электродных процессов: А(-) Сr - 3e → Cr3+ К(+) Cr3+ + 3e → Cr Электродвижущая сила элемента: Е = φ (0, 02М) - φ (0, 001М) = -0, 744 - (-0, 799) = 0, 025 В. Задача 3. Определите массу серебра и объем кислорода, выделившихся на электродах, при электролизе водного раствора нитрата серебра с инертным анодом, если время электролиза 25 мин., а сила тока 3 А. Составьте схему электролиза. Решение. При электролизе водного раствора AgNO3 на электродах протекают процессы: AgNO3 → Ag+ + NO3– (-) Катод ← Ag+ NO3– → Анод (+) H2O Ag + + e → Ag 2H2O – 4е → O2 + 4H+ На катоде протекает восстановление катионов серебра, на аноде – окисление молекул воды с выделением кислорода. В прианодном пространстве накапливаются ионы NO3– и H+, образуя кислоту HNO3. Суммарное уравнение электролиза: 4AgNO3 + 2H2O По законам Фарадея масса выделившихся на электродах веществ:
Масса выделившегося на катоде серебра:
При определении объемов выделившихся газов закон Фарадея имеет вид:
,
где V – объем выделившегося газа, л; Vэ – эквивалентный объем газа (объем, занимаемый при данных условиях одним эквивалентом газа), л. Молярная масса кислорода М(О2) = 32 г/моль, эквивалентная масса кислорода Мэ(О2) = 8 г/моль. Эквивалентный объем рассчитываем исходя из следствия закона Авогадро: 22, 4 л - 32 г/моль х л - 8 г/моль Эквивалентный объем кислорода равен 5, 6 л, тогда объем выделившеегося при электролизе кислорода:
Напишите уравнения электродных процессов, токообразующую реакцию и вычислите ЭДС гальванического элемента, состоящего из двух электродов, приведенных в таблице 5. Приведите схематическую запись этого элемента. Таблица 6
Продолжение табл. 6
Продолжение табл. 6
1352. Составьте схему процессов, происходящих при электролизе раствора BaCl2 (электроды инертные). 1353. При электролизе раствора CuSO4 масса медного катода за 2 часа увеличилась на 5 г. Какова сила тока, пропущенного через раствор? 1354. Составьте схему процессов, протекающих на инертных электродах при электролизе раствора Al2(SO4)3. 1355. Какой объём кислорода (н. у.) выделится при пропускании тока силой 4 А в течение 20 минут через раствор KOH? 1356. Составьте схему процессов, протекающих на медных электродах при электролизе раствора K2SO3. 1357. При электролизе соли некоторого металла за 2 часа 24 мин 45 с при силе тока 8 А на катоде выделилось 6, 48 г этого металла. Определите эквивалентную массу металла. 1358. Составьте схему процессов, происходящих на инертных электродах при электролизе раствора AgNO3. 1359. Определите объём выделившегося кислорода (н.у.) при электролизе на инертных электродах раствора K2SO4 при пропускании тока силой 5 А в течение 1 часа. 1360. Составьте схему процессов, происходящих на инертных электродах при электролизе водного раствора ZnCl2, если: 1) анод цинковый; 2) анод платиновый. 1361. Сколько минут потребуется для выделения всей меди из 50 мл 0, 3 н. раствора CuSO4, при силе тока 2 А? 1362. Составьте схемы электродных процессов, происходящих при электролизе водного раствора КCl (электроды инертные). 1363. При электролизе раствора соли неизвестного металла за 4, 2 мин при силе тока 1, 8 А выделилось 0, 15 г этого металла. Определите эквивалентную массу металла. 1364. Какие процессы будут протекать при электролизе водного раствора KBr, если электроды будут медными? 1365. Определите металл, имеющий степень окисления в соединениях +2, для выделения 1, 97 г которого из раствора его соли потребовалось пропускать ток силой 3 А в течение 36 мин. 1366. Составьте схему процессов, протекающих при электролизе раствора FeCl2, если: а) электроды угольные; б) электроды железные. 1367. Составьте схемы электродных процессов, происходящих при электролизе водного раствора NaCl (электроды инертные). 1368. Чему равна эквивалентная масса кадмия, если для выделения 1 г этого металла надо пропустить через раствор его соли 1717 Кл электричества? 1369. Составьте схему процессов, происходящих при электролизе водного раствора AlCl3 (электроды инертные). 1370. Какова продолжительность электролиза 250 мл 6 % (по массе) раствора PbCl2 ( 1371. Составьте схему процессов, происходящих на угольных электродах при электролизе водного раствора Na2CO3. 1372. При электролизе водного раствора AgNO3 в течение 50 мин при силе тока 3 А на катоде выделилось 9, 6 г серебра. Определите выход металла в процентах от теоретического. 1373. Составьте схему процессов, происходящих на угольных электродах при электролизе водного раствора KNO3. 1374. При электролизе водного раствора NaOH при пропускании тока силой 2 А на аноде выделилось 2, 8 л кислорода (н.у.). Определите продолжительность процесса в минутах. 1375. Составьте схему процессов, протекающих при электролизе водного раствора SnCl2 (электроды инертные). 1376. Вычислите время, необходимое для выделения 2, 8 г меди при электролизе водного раствора CuSO4 при силе тока 6 А. 1377. Составьте схему процессов, происходящих при электролизе водного раствора MnCl2 (анод медный). 1378. Какое количество кальция выделится при пропускании тока силой 18 А в течение 45 мин через расплав CaCl2? 1379. Составьте схему процессов, происходящих при электролизе водного раствора и расплава КBr (электроды инертные). 1380. Рассчитайте время, необходимое для осаждения на катоде 6, 4 г металлической меди при пропускании тока силой 5, 36 А через водный раствор CuSO4. 1381. Составьте схему процессов, протекающих при электролизе водного раствора Cr2(SO4)3 (электроды угольные). 1382. Сколько хлора и водорода выделится при н. у. за сутки проведения электролиза водного раствора NaCl, если сила тока будет равна 2 А? 1383. Какие газы выделятся на аноде при электролизе водных растворов солей NaNO3 и MgSO4? Составьте схемы электролиза (электроды инертные). 1384. Вычислите массу свинца, выделившегося на катоде в результате пропускания тока силой 3 А через расплав PbBr2 в течение 30 минут. 1385. Составьте схему процессов, происходящих при электролизе водного раствора ZnSO4 (анод цинковый). 1386. Какая масса скандия может быть получена при электролизе ScCl3, если через расплав этой соли пропустить ток силой 6 А в течение 10 мин? 1387. Составьте схему процессов, протекающих при электролизе водного раствора CaCl2 (электроды инертные). 1388. Определите силу тока, пропущенного через водный раствор NaCl, если за 2 часа на аноде выделилось 67, 2 л хлора (н.у.). 1389. Составьте схему электролиза водного раствора CuCl2 (электроды угольные). 1390. Какой объём газа (н.у.) выделится на катоде при пропускании тока силой 5 А в течение 10 часов через раствор MgSO4? 1391. Составьте схему процессов, протекающих при электролизе водного раствора CuSO4, если анод изготовлен из никеля. 1392. Ток силой 10 А в течение 30 мин пропускали через водный раствор PbCl2. Определите газ, выделяющийся на аноде и его объём (н.у.). 1393. Составьте схему процессов, происходящих на угольных электродах, при электролизе водного раствора хлорида меди (II). 1394. Сколько электричества (в Кл) необходимо для получения: а) 22, 4 л водорода; в) 6, 4 кг кислорода электрохимическим путем? 1395. Составьте схему процессов, происходящих на цинковых электродах, при электролизе водного раствора хлорида цинка (II). 1396. За 40 мин проведения электролиза водного раствора NiSO4 анод, выполненный из никеля, потерял в весе 1, 957 г. Чему была равна сила тока? 1397. Ток силой 4 А в течение 40 минвыделил на катоде 10, 3 г некоторого металла. Вычислить эквивалентную массу этого металла. 1398. Составьте схему процессов, происходящих на серебряных электродах, при электролизе водного раствора нитрата серебра (I). 1399. Электролизер содержит раствор Pb(NO3)2. Анод свинцовый. Сила тока 5 А, продолжительность электролиза 2 ч 40 мин 50 сек. Вычислить теоретическую потерю массы свинцового анода в результате электроокисления. 1400. Составьте схему процессов, происходящих на медных электродах, при электролизе водного раствора нитрата калия. 1401. Ток силой 5А в течение 30 минпропускался через расплав PbCl2. Вычислить массу выделившегося свинца и объем образовавшегося хлора (н.у.). 1402. Составьте схему процессов, происходящих на платиновых электродах, при электролизе водного раствора нитрата калия. 1403. Сколько минут необходимо пропускать ток силой 2 Адля получения 20 ггидроксида натрия электролизом водного раствора хлорида натрия? 1404. Составьте схему процессов, происходящих на никелевых электродах, при электролизе водного раствора нитрата калия. 1405. Сколько минут надо пропускать ток силой 2, 5 Ачерез расплавленный хлорид свинца (II) для того, чтобы на катоде выделилось 20 гметалла? 1406. Составьте схему процессов, происходящих на угольных электродах, при электролизе водного раствора хлорида натрия. 1407. Электролизом водного раствора гидроксида натрия за 1 ч получено 300 мл кислорода (при 200C и 740 мм рт.ст.). Чему была равна сила тока? 1408. Составьте схему процессов, происходящих на цинковых электродах, при электролизе водного раствора хлорида калия. 1409. Одной и той же силы ток одновременно пропускался через водный раствор H2SO4 и (в отдельном электролизере) через расплав хлорида цинка. В результате электролиза раствора серной кислоты получено 200 мл водорода, измеренных при 25°С и 740 мм рт. Ст.(газ сухой). Сколько теоретически должно выделиться цинка на катоде второго электролизера? 1410. Составьте схему процессов, происходящих на платиновых электродах, при электролизе водного раствора сульфата марганца (II). 1411. При электролизе соли некоторого металла за 3 ч 24 мин при силе тока 8 А на катоде выделилось 29, 78 гэтого металла. Определите металл, его его степень окисления в соединениях +2. 1412. Составьте схему процессов, протекающих на медных электродах при электролизе водного раствора Cr2(SO4)3. 1413. Составьте схему процессов, происходящих при электролизе водного раствора MnCl2 (анод медный). 1414. Составьте схему процессов, протекающих на медных электродах при электролизе водного раствора PbSO4. 1415. При электролизе током 4 А в течение 20 мин выделилось на катоде 1, 63 г металла (+2). Определите металл. 1416. Составьте схему процессов, протекающих на инертных электродах при электролизе водного раствора Al2(SO4). 1417. Какой объём кислорода (н. у.) выделится при пропускании тока силой 4А в течение 50 минут через водный раствор K2 SO4? 1418. Составьте схему процессов, протекающих при электролизе водного раствора CuSO4, если анод изготовлен из никеля. 1419. Ток силой 20 А в течение 30 мин пропускали через водный раствор PbCl2. Определите объём выделившегося хлора (н. у.). 1420. Составьте схему процессов, происходящих на угольных электродах при электролизе водного раствора нитрата висмута (III). 1421. Через волный раствор сульфата магния пропускают ток силой 5, 2 А в течение 18 мин. Какие газообразные вещества выделяются на электродах и каков их объем (н.у.)? 1422..Составьте схему процессов, протекающих на никелевых электродах при электролизе водного раствора K2SO3. 1423. При электролизе соли некоторого металла (+2) за 4 часа 45 с при силе тока 5 А на катоде выделилось 24, 5 г этого металла. Определите металл. 1424. Составьте схему процессов, происходящих на угольных электродах при электролизе водного раствора KNO3. 1425. При электролизе водного раствора NaOH при пропускании тока силой 2 А на аноде выделилось 2, 8 л кислорода (н.у.). Определите продолжительность процесса в минутах. 1426. Составьте схему процессов, протекающих при электролизе водного раствора CaCl2 если: а) электроды угольные; б) электроды железные. 1427. Определите молярную концентрацию водного раствора AgNO3, если для выделения всего серебра из 50 мл раствора потребовалось пропускать ток силой 0, 4 А в течение 30 мин. 1428. Составьте схему процессов, происходящих на инертных электродах при электролизе водного раствора CuCl2, если: 1) анод цинковый; 2) анод платиновый. 1429. Составьте схему процессов, происходящих на инертных электродах при электролизе водного раствора AgNO3. 1430. Определите объём выделившегося кислорода (н. у.) при электролизе на инертных электродах водного раствора K2SO4 при пропускании тока силой 8 А в течение 3 часов. 1431. При электролизе водного раствора сульфата никеля (II) на аноде происходит выделение кислорода. Из какого материала сделан анод: 1) из никеля; 2) из меди; 3) из платины? 1432. Составьте схему процессов, протекающих при электролизе водного раствора SnCl2 (электроды инертные). 1433. Составьте схему процессов, происходящих при электролизе водного раствора BaCl2 (электроды инертные). 1434. Электролиз водного раствора соли привел к увеличению рН в катодном пространстве. Какая из солей – BaSO4, CuSO4, ZnCl2 – подвергалась электролизу? 1435. Какие процессы будут протекать при электролизе водного раствора KBr, если электроды будут медными? 1436. Определите металл, имеющий степень окисления в соединениях +2, для выделения 2, 98 г которого из раствора его соли потребовалось пропускать ток силой 2 А в течение 75 мин. 1437. Составьте схему процессов, происходящих при электролизеводного раствора AlCl3 (электроды инертные). 1438. Какова продолжительность электролиза 250 мл 6 % (по массе) раствора PbCl2 ( 1439. Составьте схему процессов, происходящих при электролизе водного раствора и расплава KCI (электроды инертные). 1440. При электролизе водного раствора нитрата железа (II) на аноде происходит выделение кислорода. Из какого материала сделан анод: 1) из меди; 2) из железа; 3) из платины? 1441. Вычислите массу свинца, выделившегося на катоде в результате пропускания тока силой 3 А через расплав PbBr2 в течение 30 минут. 1442. Составьте схему процессов, происходящих на угольных электродах при электролизе водного раствора Na2CO3. 1443. При электролизе водного раствора AgNO3 в течение 40 мин при силе тока 2, 5 А на катоде выделилось 9, 0 г серебра. Определите выход металла в процентах от теоретического. 1444. Водный раствор содержит смесь сульфатов меди (II), хрома (III) и цинка (II) одинаковой концентрации. В какой последовательности будут выделяться металлы при электролизе? Запишите анодные и катодные процессы. 1445. Составьте схему процессов, протекающих при электролизе водного раствора Cr2(SO4)3 (электроды угольные). 1446. Составьте схему процессов, происходящих при электролизе водного раствора ZnSO4 (анод цинковый). 1447. Какая масса скандия может быть получена при электролизе ScCl3, если через расплав этой соли пропустить ток силой 4 А в течение 50 мин? 1448. При электролизе водного раствора сульфата алюминия на аноде выделилось 2 л газа при 150 С и давлении 735 мм.рт.ст. Определите эквивалентную концентрацию раствора Al2(SO4)3. 1449. Электролиз водного раствора соли привел к уменьшению рН в анодном пространстве. Какая из солей – Fe(NO3)2, KNO3, SnBr2 – подвергалась электролизу? Составьте уравнения процессов, протекающих на электродах. 1450. Какой объём водорода (н.у.) выделится при пропускании тока силой 5 А в течение двух часов через водный раствор MgSO4? 1451. При электролизе водного раствора нитрата натрия на аноде происходит выделение кислорода. Из какого материала сделан анод: 1) из свинца; 2) из графита; 3) из серебра? Запишите уравнения протекающих процессов. 1452. При какой силе тока можно в течении 15 минут выделить всю медь из 120 мл 0, 2 н. раствора нитрата меди? Составьте схему электролиза водного раствора нитрата меди. 1453. Сколько минут потребуется для выделения всей меди из 40 мл 0, 5 н. раствора CuS04? Сила тока 1, 3 А. Напишите уравнения электродных реакций, происходящих при электролизе водного раствора сульфата меди. 1454. При электролизе водного раствора AgNO3 в течение 50 минут при силе тока 3 А на катоде выделилось 8, 6 г серебра. Определите выход серебра в процентах от теоретического. Составьте схему электролиза раствора нитрата серебра. 1455. Составьте схему процессов, происходящих на угольных электродах при электролизе водного раствора Fe(NO3)2. 1456. Напишите уравнения электродных реакций и вычислите объем хлора, выделенного при электролизе водного раствора NaCl током 10 А в течении 0, 5 часа. 1457. Ток силой 10 А проходит через электролизер, в котором находится 0, 5 л 4, 5%-ного раствора NaOH (ρ = 1, 05 г/мл), через сколько часов концентрация NaOH достигнет 10%? 1458. Ток силой 2, 6 А проходя через раствор электролита, за 80 мин выделяет из раствора 2, 5 г металла. Найдите эквивалентную массу металла. 1459. Составьте схему процессов, происходящих на железных электродах, при электролизе водного раствора хлорида цинка (II). 1460. Чему равна сила тока, если при электролизе водного раствора хлорида магния в течение 1 часа выделилось 16, 8 л водорода (н.у.)? Определите объём газа выделившегося на аноде. 1461. Составьте схему процессов, происходящих на цинковых электродах при электролизе водного раствора нитрата висмута (III). 1462. Какие процессы протекают при электролизе водного раствора хлорида никеля (II), если оба электрода сделаны из никеля? Как изменится масса анода при пропускании тока силой 3, 2 А в течение 30 мин? 1463. Составьте схему процессов, происходящих на серебряных электродах при электролизе водного раствора нитрата серебра. 1464. При рафинировании меди (электролиз раствора сульфата меди с медным анодом) током силой 50 А в течение 4 ч выделяется 224 г меди. Определите выход по току. Какие процессы протекают на аноде и катоде? 1465. Составьте схему процессов, происходящих на платиновых электродах при электролизе водного раствора сульфата хрома (III). 1466. Для получения 50 л (н.у.) хлора при электролизе водного раствора хлорида магния было пропущено через раствор 0, 45•106 Кл электричества. Определите выход по току и запишите процессы, происходящие на платиновых электродах. 1467. Составьте схему процессов, происходящих на никелевых электродах при электролизе водного раствора нитрата никеля (II). 1468. При электролизе водного раствора CuCl2 в течение 20 мин при силе тока 3 А на катоде выделилось 0, 95 г меди. Определите выход по току. 1469. Чему равна сила тока, если при электролизе водного раствора хлорида калия в течение 2 часа выделилось 4, 18 л водорода (н.у.)? Определите объём газа выделившегося на аноде. 1470. Ток силой 10 А проходит через электролизер, в котором находится 2, 5 л 10%-ного раствора КOH (ρ = 1, 15 г/мл), через сколько часов концентрация NaOH достигнет 15%? 1471. Напишите уравнения электродных реакций и вычислите объем газа, выделяющегося на аноде при электролизе водного раствора Na2SO4 током 3 А в течении 2 часов. 1472. Сколько минут потребуется для выделения всей меди из 80 мл 0, 2 н. раствора CuSО4? Сила тока 2 А. Напишите уравнения электродных реакций, происходящих при электролизе водного раствора сульфата меди. 1473. Какова продолжительность электролиза 500 мл 5 % (по массе) водного раствора PbCl2 ( 1474. Определите молярную концентрацию водного раствора AgNO3, если для выделения всего серебра из 70 мл раствора потребовалось пропускать ток силой 2 А в течение 30 мин. 1475. Какой объём кислорода (н. у.) выделится при пропускании тока силой 6 А в течение 10 минут через водный раствор K2 SO4? 1476. При электролизе раствора CuSO4 масса медного катода за 1, 5 часа увеличилась на 6 г. Какова сила тока, пропущенного через раствор? 1477. При электролизе водного раствора NaOH при пропускании тока силой 1, 5 А на аноде выделилось 5, 6 л кислорода (н.у.). Определите продолжительность процесса в минутах. 1478. Составьте схему процессов, протекающих при электролизе водного раствора SnCl2, если электроды медные. 1479. Вычислите время, необходимое для выделения 8 г меди при электролизе водного раствора CuSO4 при силе тока 2 А. 1480. Составьте схему процессов, происходящих при электролизе водного раствора MnCl2 (анод платиновый). 1481. Какая масса кальция выделится при пропускании тока силой 5 А в течение 35 мин через расплав CaCl2?
|



 .
. 4Ag + O2 + 4HNO3
4Ag + O2 + 4HNO3 .
. Эквивалентная масса серебра в AgNO3:
Эквивалентная масса серебра в AgNO3: 

 .
.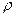 = 1, 05 г/мл), если сила тока равна 5, 8 А?
= 1, 05 г/мл), если сила тока равна 5, 8 А?


