Решение типовых задач. Пример 1. Вычислите осмотическое давление раствора, содержащего в 1,5 л 135 г глюкозы C6H12O6 при 0 0С
Пример 1. Вычислите осмотическое давление раствора, содержащего в 1, 5 л 135 г глюкозы C6H12O6 при 0 0С. Решение: Осмотическое давление определяется по закону Вант-Гоффа: См RТ Молярную концентрацию раствора находим по формуле:
Подставляя значение молярной концентрации в выражение закона Вант-Гоффа, рассчитываем осмотическое давление: π = См RТ = 0, 5 моль/л ∙ 8, 314 Па∙ м3/моль∙ К∙ 273=1134, 86 ∙ 103 Па Пример 2. Определите температуру кипения раствора, содержащего 1, 84 г нитробензола C6H5NO2 в 10 г бензола. Температура кипения чистого бензола 80, 2 0С. Решение: Температура кипения раствора на ∆ tкип будет выше, чем температура кипения чистого бензола: tкип(раствора)= tкип(растворителя) + ∆ tкип; По закону Рауля: ∆ tкип = Е∙ Сm, где Е -эбуллиоскопическая константа растворителя (табличная величина), Сm – моляльная концентрация раствора, моль/кг
∆ tкип = Е∙ Сm = 1, 5 ∙ 2, 53=3, 8 0С. tкип(раствора)= tкип(растворителя) + ∆ tкип = 80, 2 0С +3, 8 0С=84 0С.
901. Раствор, содержащий 57 г сахара С12Н22О11 в 500 г воды, кипит при 100, 72 0С. Определите эбуллиоскопическую константу воды. 902. Раствор, содержащий 4, 6 г глицерина С3Н8О3 в 71 г ацетона, кипит при 56, 73 0С. Определите эбуллиоскопическую константу ацетона, если температура кипения ацетона 56 0С. 903. Вычислите температуру кипения раствора, содержащего 2 г нафталина С10Н8 в 20 г эфира, если температура кипения эфира 35, 6 0С, а его эбуллиоскопическая константа 2, 16. 904. 4 г вещества растворены в 100 г воды. Полученный раствор замерзает при -0, 93 0С. Определите молекулярную массу растворённого вещества. 905. Определите относительную молекулярную массу бензойной кислоты, если 10 % раствор её кипит при 37, 57 0С. Температура кипения эфира 35, 6 0С, а его эбуллиоскопическая константа 2, 16. 906. Понижение температуры замерзания раствора, содержащего 12, 3 г нитробензола С6Н5NО2 в 500 г бензола, равно 1, 02 0С. Определите криоскопическую константу бензола. 907. Температура замерзания уксусной кислоты 17 0С, криоскопическая константа 3, 9. Определите температуру замерзания раствора, содержащего 0, 1 моль растворенного вещества в 500 г уксусной кислоты СН3СООН. 908. Раствор, содержащий 2, 175 г растворённого вещества в 56, 25 г воды, замерзает при -1, 2 0С. Определите относительную молекулярную массу растворённого вещества. 909. При какой температуре кипит раствор, содержащий 90 г глюкозы С6Н12О6 в 1000 г воды? 910. В 200 г спирта растворены 5 г вещества. Раствор кипит при 79, 2 0С. Определите относительную молекулярную массу вещества, если эбуллиоскопическая константа спирта 1, 22. Температура кипения спирта 78, 3 0С. 911. Водный раствор сахара замерзает при -1, 1 0С. Определите массовую долю (%) сахара С12Н22О11 в растворе. 912. В какой массе воды следует растворить 46 г глицерина С3Н8О3, чтобы получить раствор с температурой кипения 100, 104 0С? 913. Раствор, содержащий 27 г вещества в 1 кг воды, кипит при 100, 078 0С. Определите относительную молекулярную массу растворённого вещества. 914. Вычислите массу воды, в которой следует растворить 300 г глицерина С3Н8О3 для получения раствора, замерзающего при – 2 0С. 915. Раствор глюкозы в воде показывает повышение температуры кипения на 0, 416 0С. Вычистите понижение температуры замерзания этого раствора. 916. Вычислите температуру замерзания 20 % раствора глицерина С3Н8О3 в воде. 917. В 250 г воды растворены 1, 6 г вещества. Раствор замерзает при -0, 2 0С. Вычислите относительную молекулярную массу растворенного вещества. 918. Раствор, содержащий 0, 5 г ацетона (СН3)2СО в 100 г уксусной кислоты, дает понижение температуры замерзания на 0, 34 0С. Определите криоскопическую константу уксусной кислоты. 919. Вычислите массовую долю (%) глицерина в водном растворе, температура кипения которого 100, 39 0С. 920. Сколько граммов этиленгликоля С2Н4(ОН)2 требуется прибавить на каждый килограмм воды для приготовления антифриза с точкой замерзания -9, 3 0С? 921. Раствор, содержащий 565 г ацетона и 11, 5 г глицерина С3Н5(ОН)3 кипит при 56, 38 0С. Чистый ацетон кипит 56 0С. Вычислите эбуллиоскопическую константу ацетона. 922. При какой температуре замерзает 4 % раствор этилового спирта С2Н5ОН в воде? 923. Определите массовую долю (%) сахара С12Н22О11 в водном растворе, если раствор закипает при 101, 04 0С. 924. Какой из растворов будет замерзать при более низкой температуре: 10 % раствор глюкозы С6Н12О6 или 10 % раствор сахара С12Н22О11? 925. Вычислите температуру замерзания 12 % водного (по массе) раствора глицерина С3Н8О3. 926. Вычислите температуру кипения раствора, содержащего 100 г сахарозы C12H22O11 в 750 г воды. 927. Раствор, содержащий 8, 535 г NaNO3 в 100 г воды, кристаллизуется при t = -2, 8 0С. Определите криоскопическую постоянную воды. 928. Для приготовления охлаждающей жидкости на 20 л воды взято 6 г глицерина ( 929. Определите количество этиленгликоля C2H4(OH)2, которое необходимо добавить к 1 кг воды для приготовления раствора с температурой кристаллизации –15 0С. 930. Определите температуру кристаллизации раствора, содержащего 54 г глюкозы C6H12O6 в 250 г воды. 931. Раствор, содержащий 80 г нафталина C10H8 в 200 г диэтилового эфира, кипит при t = 37, 5 0C, а чистый эфир – при t = 35 0C. Определите эбулиоскопическую константу эфира. 932. При добавлении 3, 24 г серы в 40 г бензола C6H6 температура кипения повысилась на 0, 91 0С. Из скольких атомов состоят частицы серы в растворе, если эбуллиоскопическая постоянная бензола равна 2, 57 0С. 933. Раствор, содержащий 3, 04 г камфоры C10H16O в 100 г бензола С6Н6, кипит при t = 80, 714 0C. (Температура кипения бензола равна 80, 20 0С). Определите эбулиоскопическую постоянную бензола. 934. Сколько граммов карбамида (мочевины) CO(NH2)2 необходимо растворить в 125 г воды, чтобы температура кипения повысилась на 0, 26 0С. Эбуллиоскопическая постоянная воды 0, 52 0С. 935. Вычислите температуру кипения 6% (по массе) водного раствора глицерина C3H8O3. 936. Вычислите массовую долю сахарозы С12Н22О11 в водном растворе, температура кристаллизации которого 0, 41 0С. 937. При растворении 0, 4 г некоторого вещества в 10 г воды температура кристаллизации раствора понизилась на 1, 24 0С. Вычислите молярную массу растворённого вещества. 938. Вычислите температуру замерзания 5% (по массе) раствора сахара С12Н22О11 в воде. 939. Сколько граммов глюкозы С6Н12О6 следует растворить в 300 г воды для получения раствора с температурой кипения 100, 5 0С? 940. Раствор, содержащий 8, 5 г некоторого неэлектролита в 400 г воды, кипит при температуре 100, 78 0С. Вычислите молярную массу растворенного вещества. 941. При растворении 0, 4 г некоторого вещества в 10 г воды температура кристаллизации раствора стала –1, 24 0С. Определите молярную массу растворенного вещества. 942. Вычислите массовую долю сахара С12Н22О11 в растворе, температура кипения которого 100, 130С. 943. Вычислите температуру кристаллизации 25% (по массе) раствора глицерина С3Н8О3 в воде. 944. Температура кристаллизации бензола С6Н6 5, 5 0С, криоскопическая константа 5, 12. Вычислите молярную массу нитробензола, если раствор, содержащий 6, 15 г нитробензола в 400 г бензола, кристаллизуется при 4, 860С. 945. Раствор глицерина С3Н8О3 в воде показывает повышение температуры кипения на 0, 5 0С. Вычислите температуру кристаллизации этого раствора. 946. Вычислите массовую долю мочевины СО(NH2)2 в водном растворе, температура кристаллизации которого –50С. 947. В каком количестве воды следует растворить 300 г бензола С6Н6 для получения раствора с температурой кристаллизации –20 0С? 948. Вычислите температуру кипения 15% (по массе) раствора глицерина С3Н8О3 в ацетоне, если температура кипения ацетона 56, 10С, а эбулиоскопическая постоянная равна 1, 73. 949. Вычислите осмотическое давление раствора при 17 0С, если 1 л его содержит 18, 4 г глицерина C3H5(OH)3. 950. В 1 мл раствора содержится 1015 молекул растворённого вещества. Вычислите осмотическое давление раствора при 0 0С. В каком объёме содержится 1 моль растворённого вещества? 951. Сколько молекул растворённого вещества содержится в 1 мл раствора, осмотическое давление которого при 54 0С равно 6065 Па? 952. Вычислите осмотическое давление 25% (по массе) раствора сахарозы C12H22O11 при 15 0C (ρ = 1, 105 г/мл). 953. При какой температуре осмотическое давление раствора, содержащего в 1 л воды 45 г глюкозы C6H12O6, достигнет 607, 8 кПа? 954. Вычислите осмотическое давление 0, 25М раствора сахара С12Н22О11 при 380С. 955. При какой температуре осмотическое давление раствора, содержащего в 1 л 60 г глюкозы С6Н12О6, достигнет 3 атм? 956. Осмотическое давление раствора, объем которого 5 л, при 27 0С равно 1, 2 ∙ 105 Па. Какова молярная концентрация этого раствора? 957. Сколько граммов этилового спирта С2Н5ОН должен содержать 1 л раствора, чтобы его осмотическое давление было таким же, как и раствора, содержащего в 1 л при той же температуре 4, 5 г формальдегида СН2О. 958. Сколько граммов этилового спирта С2Н5ОН надо растворить в 500 мл воды, чтобы осмотическое давление этого раствора при 20 0С равно 4, 052 ∙ 105 Па? 959. 200 мл раствора содержат 1 г растворённого вещества и при 20 0С имеют осмотическое давление 0, 43 ∙ 105 Па. Определите молярную массу растворенного вещества. 960. Определите молярную массу растворенного вещества, если раствор, содержащий в 0, 5 л 6 г вещества, при 17 0С обладает осмотическим давлением 4, 82 ∙ 105 Па. 961. Сколько граммов глюкозы C6H12O6 должен содержать 1 л раствора, чтобы его осмотическое давление было таким же, как и раствора, содержащего в 1 л при той же температуре 34, 2 г сахара C12H22O11? 962. 400 мл раствора содержат 2 г растворённого вещества при 27 0С. Осмотическое давление раствора 1, 216 ∙ 105 Па. Определите молярную массу растворённого вещества. 963. Раствор сахара C12H22O11 при 0 0С оказывает осмотическое давление 7, 1 ∙ 105 Па. Сколько граммов сахара содержится в 250 мл такого раствора? 964. 2, 45 г карбамида содержатся в 7 л раствора. Осмотическое давление раствора при 0 0С равно 1, 317 ∙ 105 Па. Вычислите молярную массу карбамида. 965. Определите осмотическое давление раствора, в 1 л которого содержится 3, 01 ∙ 1023 молекул при 0 0С. 966. Водные растворы фенола С6Н5ОН и глюкозы C6H12O6 содержат в 1 л равные массы растворенных веществ. В каком из растворов осмотическое давление больше при одинаковой температуре? Во сколько раз? 967. Раствор, содержащий 3 г неэлектролита в 250 мл воды, замерзает при температуре – 0, 348 0С. Вычислите молярную массу неэлектролита. 968. Раствор, содержащий в 1 л 7, 4 г глюкозы С6Н12О6 при температуре 27 0С имеет одинаковое осмотическое давление с раствором мочевины CO(NH2)2. Сколько г мочевины содержится в 500 мл раствора? 969. Осмотическое давление раствора, в 1 л которого содержится 4, 65 г анилина С6Н5NH2, при температуре 210С равно 122, 2 кПа. Вычислите молярную массу анилина. 970. Вычислите осмотическое давление при температуре 20 0С 4% раствора сахара С12Н22О11, плотность которого равна 1, 014 г/мл. 971. Определите осмотическое давление раствора, содержащего 90, 08 г глюкозы С6Н12О6 в 4 литрах при температуре 27 0С. 972. Раствор, объемом 4 литра, содержит при температуре 0 0С 36, 8 г глицерина (С3Н8О3). Чему равно осмотическое давление этого раствора? 973. При 0 0С осмотическое давление раствора сахарозы С12Н22О11 равно 3, 55∙ 105 Па. Какая масса сахарозы содержится в 1 л раствора? 974. Определите величину осмотического раствора, в 1 литре которого с одержится 0, 4 моль неэлектролита при температуре 17 0С. 975. Чему равно осмотическое давление раствора, содержащего в 2, 5 литрах раствора 6, 2 г анилина (C6H5NH2) при температуре 21 0С. 976. При 0 0С осмотическое давление раствора сахарозы С12Н22О11 равно 3, 55∙ 105 Па. Какая масса сахарозы содержится в 1 л раствора? 977. При какой температуре будет замерзать водный раствор этилового спирта, если массовая доля С2Н5ОН равна 25%? 978. Раствор, содержащий 0, 162 г серы в 20 г бензола, кипит при температуре на 0, 081 0С выше, чем чистый бензол. Рассчитайте молекулярную массу серы в растворе. Сколько атомов содержится в одной молекуле серы? 979. К 100 мл 0, 5 моль/л водного раствора сахарозы С12Н22О11 добавлено 300 мл воды. Чему равно осмотического давления полученного раствора при 25 0С? 980. Определите температуры кипения и замерзания раствора, содержащего 1 г нитробензола С6Н5NО2 в 10 г бензола. Эбулоскопическая и криоскопическая константа бензола соответственно равна 2, 57 и 5, 1 К∙ кг/моль. Температура кипения чистого бензола 80, 2 0С, температура замерзания -5, 4 0С. 981. Какова температура замерзания раствора неэлектролита, содержащего 3, 01∙ 1023 молекул в одном литре воды? 982. Растворы камфары массой 0, 522 г в 17 г эфира кипит при температуре на 0, 461 0С выше, чем чистый эфир. Эбуллиоскопическая константа эфира 2, 16 К∙ кг/моль. Определите молекулярную массу камфары. 983. Температура кипения водного раствора сахарозы равна 101, 4 0С. Вычислите моляльную концентрацию и массовую долю сахарозы в растворе. При какой температуре замерзает этот раствор? 984. Молекулярная масса неэлектролита равна 123, 11 г/моль. Какая масса неэлектролита должна содержаться в 1 л раствора, чтобы раствор при 20 0С имел осмотическое давление, равное 4, 56∙ 105 Па? 985. При растворении 13, 0 неэлектролита в 400 г диэтилового эфира (С2Н5)2О температура кипения повысилась на 0, 453 К. Определите молекулярную массу растворенного вещества. 986. Определите температуру кипения водного раствора глюкозы, если массовая доля С6Н12О6 равно 20% (для воды Кэ=0, 516 К∙ кг/моль). 987. Раствор, состоящий из 9, 2 г йода и 100 г метилового спирта (СН3ОН), закипает при 65, 0 0С. Сколько атомов входит в состав молекулы йода, находящегося в растворенном состоянии? Температура кипения спирта 64, 7 0С, а его эбуллиоскопическая константа Кэ=0, 84. 988. Сколько граммов сахарозы С12Н22О11 надо растворить в 100 г воды, чтобы: а) понизить температуру кристаллизации на 1 0С; б) повысить температуру кипения на 1 0С? 989. В 60 г бензола растворено 2, 09 некоторого вещества. Раствор кристаллизуется при 4, 25 0С. Установите молекулярную массу вещества. Чистый бензол кристаллизуется при 5, 5 0С. Криоскопическая константа бензола 5, 12 К∙ кг/моль. 990. При 20 0С осмотическое давление раствора, в 100 мл которого содержится 6, 33 г красящего вещества крови – гематина, равно 243, 4 кПа. Определите молекулярную массу гематина. 991. Раствор, состоящий из 9, 2 г глицерина С3Н5(ОН)3 и 400 г ацетона кипит при 56, 38 0С. Чистый ацетон кипит при 56, 0 0С. Вычислите эбуллиоскопическую константу ацетона. 992. Давление пара воды при 30 0С составляет 4245, 2 Па. Какую массу сахара С12Н22О11 следует растворить в 800 г воды для получения раствора, давление пара которого на 33, 3 Па меньше давления пара воды? Вычислите массовую долю (%) сахара в растворе. 993. Давление пара эфира при 30 0С равно 8, 64∙ 104 Па. Какое количество неэлектролита надо растворить в 50 моль эфира, чтобы понизить давление пара при данной температуре на 2666 Па? 994. Понижение давления пара над раствором, содержащем 0, 4 моль анилина в 3, 04 кг сероуглерода, при некоторой температуре равно 1003, 7 Па. Давление пара сероуглерода при той же температуре 1, 0133∙ 105 Па. Вычислите молекулярную массу сероуглерода. 995. При некоторой температуре давление пара над раствором, содержащем 62 г фенола С6Н5О в 60 моль эфира равно 0, 507∙ 105 Па. Найдите давление пара эфира при этой температуре. 996. Давление пара воды при 50 0С равно 12334 Па. Вычислите давление пара раствора, содержащего 50 г этиленгликоля С2Н4(ОН)2 в 900 г воды. 997. Давление водяного пара при 65 0С равно 25003 Па. Определите давление водяного пара над раствором, содержащим 34, 2 г сахара С12Н22О12 в 90 г воды при той же температуре. 998. Давление пара воды при 10 0С составляет 1227, 8 Па. В каком объеме воды следует растворить 16 г метилового спирта для получения раствора, давление пара которого составляет 1200 Па при той же температуре? Вычислите массовую долю спирта в растворе (%). 999. При какой температуре будет кристаллизоваться водный раствор, в котором массовая доля метилового спирта равна 45%. 1000. Водно-спиртовой раствор, содержащий 15% спирта, кристаллизуется при – 10, 26 0С. Определите молярную массу спирта.
|

 .
.
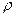 = 1, 26 г/мл). Какова будет температура замерзания приготовленного антифриза?
= 1, 26 г/мл). Какова будет температура замерзания приготовленного антифриза?


