Решение типовых задач. Задача 1.Определите возможность самопроизвольного протекания химической реакции: NO + ½ O2 = NO2
Задача 1. Определите возможность самопроизвольного протекания химической реакции: NO + ½ O2 = NO2. Решение. Возможность самопроизвольного протекания химической реакции определяется по величине свободной энергии Гиббса: Δ G = Δ H -T× Δ S. Тепловой эффект и полную энергию химической реакции находим по следствию из закона Гесса: Δ Н0298 = Δ Н0298(NO2) - Δ Н0298(NO) – ½ Δ Н0298(O2). По справочнику [6] находим: Δ Н0298(NO2) = 38, 5 кДж/моль; Δ Н0298(NO) = 90, 3 кДж/моль; Δ Н0298(O2) = 0 кДж/моль; тогда Δ Н0298(реакции) = 38, 5 - 90, 3 – ½ × 0 = - 51, 8 кДж. Изменение энтропии реакции: Δ S0298 = S0298(NO2) - S0298(NO) – ½ S0298(O2); S0298(NO2) = 240, 2 Дж/моль× К S0298(NO) = 210, 5 Дж/моль× К Δ S0298 = 240, 2 – 210, 5 – ½ × 205, 0 = - 72, 8 Дж/К = - 72, 8× 10-3 кДж/К. Находим энергию Гиббса: Δ G0298 = -51, 8 + 298× 72, 8× 10-3 = - 30, 11 кДж, Δ G0298 < 0 – следовательно, реакция в стандартных условиях протекает в прямом направлении. Δ H0298 (реакции) = Δ H0298 (СО2) + 2 Δ H0298 (Н2О ж) - Δ H0298 (СН4) - 2 Δ H0298 (О2); Δ H0298 (реакции) = - 393, 5 + 2(-285, 8) – (-75, 0) - 2× 0 = - 890, 1 кДж. Задача 2. Определите, сколько теплоты выделится при сгорании 12 л метана (условия нормальные). Решение. Записываем уравнение реакции горения метана: CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (ж). Используя следствие из закона Гесса и справочные данные [6], находим тепловой эффект данной химической реакции: Δ H0298(СН4) = - 75, 0 кДж/моль; Δ H0298 (СО2) = -393, 5 кДж/моль; Δ H0298 (Н2О ж) = -285, 8 кДж/моль; Δ H0298 (О2) = 0; тогда Далее, учитывая, что реакция протекает при нормальных условиях, определяем количество выделившейся теплоты при сгорании 12 л СН4: 22, 4 л СН4 - (-890, 1 кДж) 12, 0 л СН4 - Δ Н; Δ Н =
449. Определите температуру, при которой процесс: 4NH3 + 5O2= 4NO +6H2O начнет протекать самопроизвольно. 450. Определить сколько тепла выделится или поглотится в газовой реакции: 2NO + O2 = 2NO2, если при этом образуется 112 л (н.у.)оксида азота (IV). 451. Определить сколько тепла выделится или поглотится в реакции, если при этом образовалось 15 г серы: SO2 (г) + 2 Н2S (г) = S(т) + 2 Н2О (ж). 452. Какие из перечисленных оксидов могут быть восстановлены алюминием при 298 К: PbO, Fe2O3, Cr2O3? Ответ подтвердить реакциями и расчетами. 453. Определите возможность превращения при стандартных условиях ацетилена в бензол: 3 С2Н2 (г) = С6Н6 (ж). 454. Рассчитайте тепловой эффект реакции: Fe2O3 + 2 Al = 2 Fe + Al2O3, если было получено 336 г железа. 455. Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по реакции: PCl5(г) = PCl3 (г) +Cl2 (г), DH0 = 92, 59 кДж. 456. Какие из перечисленных оксидов могут быть восстановлены алюминием при 298 К: СаО, FeO, CuO? Ответ подтвердить реакциями и расчетами. 457. Определите, в каком направлении при стандартных условиях будут протекать следующие реакции: а) NiO + Pb = Ni + PbO; б) 3 Fe3O4 + 8 Al = 4 Al2O3 + 9 Fe. 458. Рассчитайте тепловой эффект реакции: Fe(к) +3H2O(г)= Fe2O3(к) +3H2(г), если образовалось 11, 2 л водорода (н.у.). 459. Рассчитайте, протекание какой из приведённых реакций наиболее вероятно в стандартных условиях: а) FeO(к) + C(к) = Fe(к) + CO(г); б) FeO(к) + CO(г) = Fe(к) + CO2(г) 460. Вычислите тепловой эффект реакции восстановления оксида цинка углеродом с образованием СО в стандартных условиях. 461. Определите возможность превращения при стандартных условиях бензола в ацетилен: С6Н6 (ж) = 3 С2Н2 (г). 462. Рассчитайте тепловой эффект реакции: Cr2O3 + 2Al = 2Cr + Al2O3. Какой является эта реакция - эндо- или экзотермической? 463. Вычислите стандартный тепловой эффект и запишите термохимическое уравнение реакции: Fe3O4 + 8Al = 4Al2O3 + 9Fe. 464. Рассчитайте температуру, при которой равновероятны оба направления реакции: 2AgNO3(к) = 2Ag(к) + 2NO2(г) + O2(г). 465. Рассчитайте, сколько тепла выделится при сгорании 100 г сахарозы С12Н22О11 при стандартных условиях. 466. Определите возможность протекание при стандартных условиях реакции: N2(г) + 2 H2O(г) = NH4NO2 (г). 467. Пользуясь табличными значениями 468. Восстановление Fe3O4 оксидом углерода идет по уравнению: Fe3O4 (к) + СО(г) = 3FeO(к) +СО2(г). Вычислите DG0298 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно DS0298 в этом процессе? 469. Сколько тепла выделится при реакции горения 100 л СО до СО2? 470. Рассчитайте, для каких оксидов принципиально осуществима реакция восстановления водородом в стандартных условиях: а) ZnO, б) NiO, в) Fe2O3 471. Для реакции: SiO2 + 2Mg = 2MgO + Si, вычислите тепловой эффект и, записав термохимическое уравнение, укажите, является эта реакция экзо- или эндотермической. 472. Для каких оксидов наиболее вероятна реакция восстановления водородом при стандартных условиях: а) FeO; б) Fe2O3; в) Fe3O4? 473. Вычислите энтальпию образования пропана C3H8, если при сгорании 11 г его выделилось 552 кДж тепла. 474. Определите, протекание какой реакции более вероятно при стандартных условиях: а) CO(г) + Cl2(г)=COCl2(г); б) SO2(г) + NO2(г) = SO3(г) + NO(г). 475. Определите тепловой эффект реакции: 2NH3(г) + 5/2 O2(г) = 2NO(г) + 3H2O(ж), при стандартных условиях, используя табличные значения 476. Рассчитайте температуру, при которой равновероятны оба направления реакции: СO(г) + Cl2(г) = СОCl2(г). 477. Какие из металлов могут быть восстановлены водородом из их оксидов при стандартных условиях: а) CaO; б) SnO; в) Al2O3? 478. Энтальпия сгорания метана 479. Сколько тепла выделилось или поглатилось в реакции: Fe2O3(к) + 3H2(г) = 2Fe(к) + 3Н2О(г), если прореагировало 20 л водорода? 480. Рассчитайте стандартную энтропию реакции: 2KClO3(к) =2KCl(к) + 3O2(г). Будет ли эта реакция протекать самопроизвольно в изолированной системе при стандартных условиях? 481. Рассчитайте температуру, при которой равновероятны оба направления реакции: CO2(г) + С(т) = 2СО(г). 482. Сколько тепла выделится при сжигании 38 г сероуглерода CS2, если энтальпия его образования 483. Определите, в каком направлении протекает реакция: HCl (г) + O2 (г) = 2H2O (г) + 2Cl2 (г) при стандартных условиях. 484. Определите тепловой эффект горения бензола C6H6, если при сгорании его 0, 2 моль выделяется 7540, 85 кДж тепла. 485. Определите стандартную энтальпию образования метилового спирта CH3OH, если энтальпия его сгорания 486. В каком направлении при стандартных условиях будет протекать следующая реакция: 2SO2(г) + O2(г) = 2SO3 (г)? 487. Сколько тепла выделится в процессе: СО(г) + 2Н2 (г)=СН3ОН (г), если масса вступающего в реакцию оксида углерода (II)СО равна 2, 8 кг. 488. Определите, возможно ли протекание реакции при стандартных условиях: Al2O3(к) + 3СО(г) = 2 Al(к) + 3CO2(г). 489. Исходя из уравнения реакции: CH4(г) + 2O2(г) = CO2(г) + 2H2O(ж), рассчитайте объём сгоревшего метана (н.у.), если при этом выделилось 1786 кДж тепла. 490. Можно ли использовать при стандартных условиях для получения аммиака следующую реакцию: NH4Cl(к)+NaOH(к) = NH3(г)+NaCl(к)+ H2O(г)? 491. Вычислите энтальпия образования этана С2Н6, если нтальпия его сгорания ∆ Н0сг = -1560 кДж/моль. 492. Определить сколько тепла выделится, если в реакцию вступило 80 л хлора (н.у.): 2 P(к) + 5Сl2(г) = 2PCl5(г). 493. При какой температуре наступит равновесие системы: 4HCl (г) + O2 (г) = 2H2O (г) + 2Cl2 (г), DH0 = -114, 42 кДж? 494. Определите возможность протекания при стандартных условиях реакции: H2 (г) + SO2 (г) = 3S (к) + 2H2O(г) 495. Определите стандартную энтропию реакции: Ag2CO3(к)=Ag2O(к)+CO2(г). Будет ли эта реакция протекать самопроизвольно в изолированной системе при стандартных условиях? 496. Исходя из энтальпии образования воды и теплового эффекта реакции: H2O2(ж) = Н2О(ж) + 1/2О2 ( 497. Вычислите энтальпию образования карбида кальция CaС2, исходя из теплового эффекта реакции: CaO(к) + 3C(к) = CaC2(к) + CO(г), ∆ H0 = 460 кДж. 498. Рассчитайте температуру, при которой равновероятны оба направления реакции: CuCl2 (к) + H2O (г) = CuO (к) + 2HCl (г). 499. В процессе реакции: 2SO2 (г) + О2(г) = 2SO3(г) выделилось 1000 кДж тепла. Сколько оксида серы (VI) при этом образовалось? 500. Для реакции: PbO2 (к) + Pb(к) = 2PbO(к) вычислите ∆ G0 на основании ∆ H0 и ∆ S0 реагирующих веществ. Определите, возможно ли течение этой реакция при стандартных условиях. 501. Определить возможность протекания при температуре 250 0С процесса: GeO2(к) + 2С(гр.) = Ge(к) + 2СО(г). 502. Определите при какой температуре начнется реакция восстановления Fe3O4 протекающая по уравнению: Fe3O4(к)+CO(г) = 3FeO(к) + CO2(г), DH0 = 34, 55 кДж 503. Вычислите DG0298 для следующих реакций: CaF2(к)+Cl2(г) = CaCl2(к) + F2(г); б)PbO2 (к) +2 Zn(к)= Pb(к) + 2 ZnO(к). Можно ли получить фтор по реакции (а) и восстановить PbO2 цинком по реакции (б)? 504. Приняв стандартные значения энтальпии и энтропии реакции, не зависящие от температуры, рассчитайте предельную температуру для процесса термического разложения карбоната магния: MgCO3(к) = MgO(к) + CO2(г). 505. Сколько тепла выделится, если в реакции образовалось при стандартных условиях 50 л углекислого газа (н.у.): 3Fe2O3(к) + CO(г) = 2Fe3O4(к) + CO2(г)? 506. При какой температуре возможно осуществление процесса: Na(к) + Cl2(г) = 2 NaCl(к). 507. Сколько было взято гидроксида натрия, если при его нейтрализации хлороводородом по реакции: NaОН(к)+ НС1(г) = NаС1(к) + Н2О(ж) выделилось 352, 9 кДж тепла? 508. Реакция между хлором и водородом идет по уравнению: С12(г)+Н2(г) = 2НС1(г). Зная, что при участии в реакции 1 г хлора выделяется 8, 24 кДж тепла, вычислить стандартную энтальпию образования НС1. 509. Сколько тепла выделится при сжигании 38 г сероуглерода CS2 если его энтальпия образования Δ Но = 62, 7 кДж/моль. 510. Определите, протекание какой реакции более вероятно при стандартных условиях: а) CO +Cl2 = COCl2; б) SO2 + NO2 = SO3 + NO. 511. Пользуясь табличными значениями Δ Но вычислите энтальпию сгорания этилена. 512. Рассчитайте, для каких оксидов принципиально осуществима реакция восстановления водородом в стандартных условиях: а) ZnO, б) NiO, в) SrO. 513. Для реакции Cr2O3 + 2Al = 2Cr + Al2O3 вычислите тепловой эффект, запишите термохимическое уравнение и укажите, является реакция экзо- или эндотермической. 514. Рассчитайте, протекание какой из приведённых реакций наиболее вероятно в стандартных условиях: а) FeO(к) + C(к) = Fe(к) + CO(г); б) FeO(к) + CO(г) = Fe(к) + CO2(г) 515. Вычислите стандартную энтальпию образования сахарозы C12H22O11 исходя из термохимического уравнения: C12H22O11(к) + 12 O2(г) = 12 CO(г) +11H2O(ж), Δ Но = -5694 кДж 516. Сколько тепла выделится при сгорании 12 г глюкозы? 517. Вычислить стандартное изменение энергии Гиббса для химической реакции: NH3(г)+ НCl(г)= NH4Cl(к) по значениям стандартных энтальпий образования и энтропий веществ, участвующих в реакции. 518. Вычислите при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по реакции: PCl5(г) = PCl3(г) + Cl2(г), DH0 = 92, 59 кДж 519. Какие из перечисленных оксидов могут быть восстановлены алюминием при 298 К: СаО, FeO, CuO? Ответ подтвердить реакциями и расчетами. 520. На основании стандартных энтальпий образования и абсолютных стандартных энтропий соответствующих веществ вычислите DG0298 реакции, протекающей по уравнению С2Н2(г)+ 3О2=2СО2(г)+ 2Н2О(ж). Возможна ли данная реакция при стандартных условиях? 521. Пользуясь справочными данными, покажите, что данная реакция невозможна в стандартных условиях. Сu(к) + ZnO(к) = CuO(к) + Zn(к). 522. Вычислите DН0298, DS0298, DG0298 реакции, протекающей по уравнению ТiO2 (к)+ 2C(к) = Ti(к)+ 2CO(г). Возможна ли реакция восстановления ТiO2 углеродом при 1000 и 3000К? 523. Вычислите изменение энтропии для реакций, протекающих по уравнениям: 2СН4(г) = С2Н2(г) + 3Н2(г) N2 + 3Н2(г) = 2NH3(г) С(графит) + О2(г) = СО2(г)
|

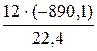 = - 4776, 8 кДж.
= - 4776, 8 кДж. H0, вычислите энтальпию сгорания этилена C2H4.
H0, вычислите энтальпию сгорания этилена C2H4.


