Решение типовых задач. Задача 1.Рассчитайте эквивалентные массы соединений: KNO3, Ca(OH)2, Р2О5
Задача 1. Рассчитайте эквивалентные массы соединений: KNO3, Ca(OH)2, Р2О5. Решение. Эквивалентная масса химического соединения рассчитывается по формуле:
Задача 2. Вычислите объем, занимаемый аммиаком массой 34 г при 27 0С и 104 кПа. Каково число молекул в данной массе газа? Решение. Определяем мольное количество аммиака: nNH3 = Находим объем данного количества газа при нормальных условия: V0 = VM ´ nH2 = 22, 4 л / моль ´ 2 моль = 44, 8 л. Пользуясь объединенным газовым законом, приводим объем аммиака к заданным условиям:
Число структурных частиц (n) в количестве вещества определяется как n = nNH3 ∙ NA = 2 моль ∙ 6, 02 ∙ 1023 моль-1 = 12, 04 ∙ 1023. Задача 3. В гидриде двухвалентного металла содержится 4, 76 % водорода по массе. Определите эквивалентную и молярную массу металла. Найдите простейшую формулу гидрида. Решение. Содержание металла в этом соединении 100 – 4, 76 = 95, 24%. Следовательно, при образовании 100 г гидрида 95, 24 г металла соединяются с 4, 76 г водорода. Используя закон эквивалентов, определяем эквивалентную массу металла:
Вычисляем молярную массу металла, зная, что его валентность равна двум: ММе = МЭ ·|W| = 20, 04 г/ моль ∙ 2 = 40, 08 г/моль. По периодической системе Д.И. Менделеева находим, что искомым металлом является Са. Для определения простейшей формулы гидрида обозначим число атомов металла в молекуле соединения через х, а водорода – через у. Тогда формула примет вид Са хНу. Число атомов элементов в простейшей формуле соединения определяется отношением количества вещества элементов, содержащихся в определенной массе вещества, например в 100г: х: у = nСа: nН = Такое отношение соответствует формуле СаН2. Задача 4. Смесь, состоящая из 0, 864 кг водорода, 9, 6 кг кислорода и х кг азота, занимает при р = 1, 487 ∙ 105 Па и Т = 298, 2К объем V = 15 м3. Определите парциальное давление газов. Решение. Из уравнения состояния рV = Sν RT определяем общее количество киломолей газа в смеси: Sν = Число молей азота в смеси: ν N2 = По закону Дальтона pi = pNi, где pi – парциальное давление газа, p – общее давление смеси, Ni объемная доля компонента: pN2 = pNN2 = 1.487 ∙ 105 ∙ pН2 = 1, 487 ∙ 105 ∙ pО2 = p – pH2 = (1, 487 – 0, 3304 – 0, 6608) ∙ 105 = 0, 4958 ∙ 105 Па.
1. Относительная плотность некоторого газа по ацетилену равна 2, 23. Определите плотность этого газа по воздуху. 2. В закрытом сосуде объемом 3 л при температуре 35 0С находится смесь газов из 10 г СО2 и 12 г О2. Найдите парциальные давления газов и общее давление газовой смеси. 3. Относительная плотность газа по азоту равна 1, 57. Определите, какой объем займут 10 г этого газа при t = 15 0С и давлении 740 мм рт. ст. 4. Определите плотность по водороду газовой смеси, состоящей из 20 об. % водорода, 40 об. % азота и 40 об. % метана. 5. Определите молярную массу газа, если масса 600 мл его при н.у. равна 1, 714 г. 6. Газ, состоящий из атомов азота и кислорода, имеет плотность по азоту, равную 1, 643. Определите эмпирическую формулу молекулы газа, если массовая доля азота в нём равна 30, 43 %. 7. Масса 43, 5 мл газа при 62 0С и 101, 3 кПа равна 0, 12 г. Определите молярную массу и массу одной молекулы этого газа. 8. Вычислите массу 70 мл азота, собранного над водой при 7 0С и 102, 3 кПа. Давление водяного пара при той же температуре равно 1 кПа. 9. Сколько времени (часов, суток, лет) потребуется, чтобы из ампулы ёмкостью 1 мл, заполненной гелием (н. у.), полностью удалить весь газ со скоростью 100 атомов в секунду. 10. В закупоренном баллоне находится газ при t = 3 0C. До какой температуры необходимо нагреть газ, чтобы давление в баллоне возросло на 40 %. 11. Относительная плотность газа по воздуху равна 2, 562. Определите массу 3, 5 л этого газа при н.у. 12. При окислении 0, 253 г свинца получено 0, 273 г оксида свинца. Определите эквивалентную массу свинца. 13. Плотность паров серы по азоту при некоторой температуре равна 9, 14. Из скольких атомов состоят парообразные частицы серы при этой температуре? 14. Для растворения 8, 43 г металла потребовалось 7, 35 г H2SO4. Определите эквивалентную массу металла и объём выделившегося водорода (н. у.). 15. В баллоне ёмкостью 5 л при t = 15 0C содержится 0, 5 моль азота и 1 моль аргона. Определите давление газовой смеси в баллоне. 16. Сколько молекул водорода выделится при взаимодействии 2, 6 г калия с водой? 17. В баллоне ёмкостью 0, 025 м3 находится при 15 0С водород под давлением 8 атм. Вычислите массу водорода. 18. В каком объёме воздуха (н. у.) содержится 1 мг аргона, если объёмное содержание аргона составляет 0, 93 %? 19. Содержание радона в воздухе составляет 6 · 10-18 об. %. В каком объёме воздуха (н. у.) содержится одна молекула радона? 20. Какой объём оксида азота (II) NO выделится при растворении 1 кг висмута в азотной кислоте (t = 17 0C и P = 102, 4 кПа)? 21. Масса 0, 5 л некоторого газа при н.у. равна 1, 806 г. Определите плотность этого газа по воздуху и метану CH4. 22. Для полного восстановления 0, 721 г оксида кальция необходимо 323 мл водорода (t = 23 0C, Р = 0, 98 · 105 Па). Определите эквивалентную массу оксида. 23. Сколько молекул содержится в 100 г NO и какой объём (н.у) они займут? 24. Газометр объёмом 10 л заполнен газом (t = 17 0C, Р = 1, 15 · 105 Па), плотность которого по водороду равна 16. Определите, какой это газ и какова его масса (вещество простое). 25. Определите относительную плотность по водороду газовой смеси, состоящей из 56 л аргона и 28 л азота (н. у.). 26. Какой объём займут 0, 12 г кислорода, собранного над водой при 14 0С и 102, 4 кПа. Давление водяного пара при той же температуре составляет 1, 6 кПа. 27. До какой температуры следует нагреть газ, находящийся при н. у., чтобы количество его молекул в единице объёма уменьшилось вдвое? 28. Газовая смесь состоит из СО и СО2, парциальные давления которых соответственно равны 0, 15·105 и 0, 9·105 Па. Вычислите объёмные доли газов в смеси. 29. Вычислите молярную массу газа и массу одной молекулы этого газа, если масса его 280 мл при 21 0С и давлении 2, 026 ·105 Па равна 0, 65 г. 30. Объёмные доли хлора и азота в газовой смеси составляют соответственно 35 и 65 %. Рассчитайте парциальное давление каждого газа, если смесь находится при давлении двух атмосфер. 31. В 7, 2 г вещества содержится 5, 42 · 1022 молекул. Определите молярную массу и массу одной молекулы этого вещества. 32. На образование 43, 239 г гидрида щелочного металла требуется 5, 6 л Н2 (н.у.). Вычислите эквивалентную массу металла. 33. Вычислите молярную массу паров йода, если их относительная плотность по водороду 127. Из скольких атомов состоят парообразные частицы йода? 34. Рассчитайте эквивалентную массу металла, 0, 2 г которого вытесняют из кислоты 180 мл водорода при 15 0С и давлении 730 мм рт. ст. 35. Озон массой 10, 7 кг при н.у. занимает объём 5 м3. Определите эмпирическую формулу озона. 36. Одно и тоже количество металла соединяется с 0, 6 г кислорода и 9, 534 г галогена. Рассчитайте эквивалентную массу галогена. 37. Какой объём при 30 0С и давлении 1, 35·105 Па занимает газ массой 12 г, если его относительная плотность по азоту равна 1, 072? 38. Рассчитайте эквивалентную массу одновалентного металла, если при пропускании через сероводород раствора, содержащего 2, 34 г хлорида этого металла, образуется 1, 56 г его сульфида. Что это за металл? 39. В комнате какого объёма находится воздух массой 50 кг при t = 21 0С и давлении 744 мм рт.ст.? 40. При взаимодействии с водой 8, 21 г металла выделилось 4, 85 л водорода, измеренного при 10 0С и давлении 99, 5 кПа. Определите эквивалентную массу металла. 41. При сжигании 3, 2 г серы в воздухе было получено 5, 8 г оксида серы. Определите эмпирическую формулу оксида. 42. Какое давление необходимо создать в баллоне объёмом 5 л, чтобы в него при 20 0С поместилось 80 г азота? 43. Какой объём при 30 0С и давлении 2·105 Па занимает газ массой 12 г, если его относительная плотность по азоту равна 1, 07 г? Найдите массу одной молекулы этого газа. 44. Определите эквивалентную и молярную массу атомов металла, имеющего в химических соединениях степень окисления +3, если 10 г этого металла вытесняет из раствора кислоты 14, 02 л водорода при температуре 45 0С и давлении 785 мм. рт.ст. 45. Определите молярную массу и массу одной молекулы газа, если при 27 0С и Р = 2, 7 · 105 Па масса 1, 85 м3 газа равна 3, 4 кг. 46. Объёмные доли газов в смеси составляют 55, 21 и 24, 00%. Смесь газов находится под давлением 0, 52 МПа. Определите парциальное давление каждого из газов. 47. Сколько молекул NaOH потребуется для нейтрализации 24, 5 г серной кислоты? 48. Определите эмпирическую формулу оксида металла (IV), если эквивалентная масса этого металла равна 13, 74 г/моль. Что это за металл? 49. В двух сосудах одинакового объёма при одинаковых условиях находятся азот и гелий. Определите соотношение числа атомов газов в сосудах. 50. При некоторой температуре относительная плотность по кислороду паров фосфора равна 3, 88. Из скольких атомов состоят парообразные частицы фосфора при этих условиях? 51. В баллоне ёмкостью 15 л при t = 20 0C находится смесь из 20 г азота и 12 г водорода. Вычислите общее давление и парциальные давления газов в баллоне. 52. Щелочной металл образует гидрид, содержащий 12, 5% водорода. Определите эквивалентную массу металла. Что это за металл? 53. Газовая смесь, состоящая из 2 г оксида углерода (II) и 10 г оксида углерода (IV), находится в баллоне ёмкостью 1 л при t = 20 0C. Определите парциальные давления СО и СО2 и общее давление смеси. 54. Эквивалентная масса серы в оксиде равна 5, 33 г/моль. Установите эмпирическую формулу оксида. 55. Какой объём при н.у. занимают 27·1021 молекул газа? Сколько времени (часов, суток, лет) потребуется, чтобы пересчитать молекулы этого газа со скоростью 0, 0012 молей в час? 56. Элемент образует хлорид состава ЭСl4 с массовой долей хлора, равной 92, 2%. Определите эквивалентную массу элемента. Что это за элемент? 57. В каком объёме фтора содержится 1020 молекул при t = 25 0C и P = 106 кПа? 58. При сгорании 5 г металла образуется 9, 44 оксида металла (III). Определите этот металл и его эквивалентную массу. 59. Металл (степень окисления +2), массой 0, 604 г, вытеснил из кислоты 100, 75 мл водорода (t = 18 0C и P = 105, 6 кПа). Какой это металл? 60. В 1 м3 газовой смеси содержится 15 моль азота, 75 моль CO2 и 10 моль O2. Вычислите парциальное давление каждого из газов и общее давление смеси при t = 27 0C. 61. Относительная плотность некоторого газа по воздуху равна 2, 562. Вычислить массу 3, 5 л этого газа при н.у. 62. В закрытом сосуде объемом 3 л при температуре 35 0С находится смесь газов из 10 г СО2 и 12 г О2. Найдите парциальные давления газов и общее давление газовой смеси. 63. Сколько литров кислорода при нормальных условиях требуется для окисления серы массой 6, 4 г и алюминия массой 5, 4? 64. Сколько весит 1 литр хлора при нормальных условиях, какова его плотность по воздуху? Какой объем занимают 142 г хлора при нормальных условиях? 65. Элемент образует гидрид, где его массовая доля равна 87, 41%. Определите эквивалентную массу металла. 66. Металл (+3) массой 0, 752 г при взаимодействии с кислотой вытеснил водород объемом 0, 936 л при нормальных условиях. Определите металл. 67. Металл массой 0, 150 г вытесняет из раствора никелевой соли никель массой 0, 367 г, а из раствора кислоты водород объемом 140 мл при нормальных условиях. Определить эквивалентную массу никеля. 68. Неизвестное вещество массой 0, 582 г находится в парообразном состоянии при температуре 35 0С и давлении 0, 99 ·105 Па и занимает объем 205 мл. Определить его молярную массу. 69. Сколько граммов калия вступило в реакцию с водой, если объем выделившегося газа при 250С и 745 мм. рт. ст. равен 480 мл? 70. В оксиде металла массовая доля кислорода равна 28, 57%. В его же соединении со фтором - массовая доля фтора равна 48, 72 %. Определите эквивалентную массу фтора. 71. Сколько литров водорода при 12 0С и 770 мм.рт.ст. выделится при взаимодействии 0, 5 кг цинка с соляной кислотой? 72. При пропускании сероводорода через раствор, содержащий 2, 98 г хлорида некоторого одновалентного металла, образуется 2, 2 г его сульфида. Вычислить эквивалентную массу металла. Что это за металл? 73. При взаимодействии 3, 24 г трехвалентного металла с кислотой выделяется 4, 03л водорода, измеренного при нормальных условиях. Вычислить эквивалентную массу металла и определить металл. 74. Рассчитать эквивалентную массу металла, если при соединении 7, 2 г металла с хлором было получено 28, 2 г соли. Эквивалентная масса хлора равна 35, 45 г/моль. 75. Какой объем в мл займут при нормальных условиях: а) 0, 85 г аммиака; б) 1, 4 г этилена; в) 128 мг иодоводорода; г) 17 мг фосфина? 76. При разложении нитрита аммония получено 7 л азота при 27 0С и давлении 760 мм.рт.ст. Сколько соли было подвергнуто разложению? 77. В закрытом баллоне находится 160 г кислорода под давлением 1 атм. и 120С. Вычислить объем кислорода в баллоне. 78. Металл массой 2 г соединяется с 17, 78 г брома и 3, 56 г серы. Эквивалентная масса серы равна 16 г/моль. Определить эквивалентные массы металла и брома. 79. Вычислить массу: а) 1 л водорода при 100 С и 720 мм.рт.ст.; б) 8 л кислорода при 130 С и 780 мм. рт. ст.; в) 224 л углекислого газа при 27 0С и 1, 5 атм. 80. При нагревании 20, 06 г металла было получено 21, 66 оксида. Найдите эквивалентную массу металла. 81. Аммиак при давлении 454, 2 мм. рт. ст. и температуре 18 0С занимает объем 832 мл. Определить число молей и массу аммиака. 82. При восстановлении водородом оксида металла массой 2, 68 г образовалась вода массой 0, 648 г. Вычислите эквивалентную массу металла. 83. Вычислить массу 450 мл диоксида серы при 80 0С и 740 мм рт ст. 84. Какой объем водорода при нормальных условиях выделится при действии избытка соляной кислоты на 130 г цинка? 85. Сколько л кислорода при 210 С и 784 мм.рт.ст. выделится при разложении 490 г бертолетовой соли? 86. Вычислите эквивалентную массу цинка, если 1, 168 г его вытеснили из кислоты 438 мл водорода, измеренного при 17 0С и давлении 98642 Па. 87. 0, 111 г некоторого газа заняли 25 мл при 17 0С и 780 мм.рт.ст. Вычислить молярную массу газа. 88. На нейтрализацию 0, 471 г фосфористой кислоты израсходовано 0, 644 г гидроксида калия. Вычислить эквивалентную массу кислоты. 89. При нормальных условиях 500 мл газа имеют массу 1, 8 г. Определить плотность газа по воздуху и его молярную массу. 90. Определите эквивалентную массу двухвалентного металла, если 14, 2 г оксида этого металла образуют 30, 2 г сульфата металла. 91. Определите эквивалентную массу двухвалентного металла, если из 48, 15 г его оксида можно получить 88, 65 г его нитрата. 92. Рассчитайте эквивалентную массу кислоты, если на нейтрализацию 0, 009 кг ее израсходовано 0, 008 кг гидроксида натрия. 93. Газ, плотность которого по воздуху равна 0, 55, содержится в сосуде емкостью 20 л под давлением 1, 038·105 Па при 20 0С. Определите массу газа в этом сосуде. 94. Одно и тоже количество металла соединяется с 4, 8 г кислорода и 48 г одного из галогенов. Какой это галоген? 95. При сгорании 5, 5 г трехвалентного металла образовалось 10, 2 г оксида. Какой взят металл? 96. При одинаковых условиях взяты 5 л водорода и 2 л кислорода. Каково численное соотношение молекул во взятых объемах газов? 97. Органическое вещество в виде летучей жидкости массой 0, 1437 г при температуре 250С и давлении 992 кПа превращено в пар, занимающий объем 22, 9 мл. Найдите молярную массу этого вещества. 98. Металл массой 3, 006 г взаимодействует с серой массой 1, 635 г. Определите эквивалентную массу металла, если эквивалентная масса серы равна 16, 03 г/моль. 99. Вычислите массу кислорода, содержащегося в баллоне емкостью 25 л при температуре 20 0С и давлении 121, 6 кПа. 100. Определите эквивалентную массу двухвалентного металла, если для полного сгорания 3, 2 г металла потребовалось 0, 26 л кислорода (н.у.). Какой это металл? 101. Газометр объемом 10 л заполнен газом. Давление в газометре 115 кПа, температура 17оС. Плотность газа по водороду равна 16. Определите, какой газ находится в газометре и какова его масса (вещество простое). 102. Элемент образует гидрид с массовой долей водорода 8, 87 %. Вычислите эквивалентную массу элемента. 103. В закрытом сосуде объемом 10 л находятся при температуре 10 0С кислород массой 2 г и метан массой 1, 6 г. Вычислите: а) парциальные давления газов; б) общее давление в сосуде; в) объемные доли газов (%) 104. Металл массой 0, 864 г образовал хлорид массой 1, 148 г. Определите эквивалентную массу металла, если эквивалентная масса хлора равна 35, 5 г/моль. 105. Вычислите эквивалентную массу цинка, если 1, 168 г его вытесняют из кислоты 438 мл водорода, измеренного при температуре 17оС и давлении 98642 Па. 106. Смешаны 2 л углекислого газа (Р = 101, 3 кПа) и 5, 6 л азота (Р = 96, 9 кПа). Каковы парциальные давления газов в смеси и общее её давление? 107. Вычислить массу 1 м3 углекислого газа при температуре 27 0С и давлении 100 кПа. 108. Определите массу металла, вступившего в реакцию с кислотой, если при этом выделился водород объёмом 260 мл (н.у.). Эквивалентная масса металла равна 9 г/моль. 109. Сколько литров воздуха, содержащего 21% (об) кислорода, потребуется (при н.у.) для сжигания 12 л паров сероуглерода CS2? 110. При растворении в серной кислоте 2, 5 г сплава цинка с магнием выделилось 1, 3 л водорода при температуре 26 0С и давлении 1, 2·105 Па. Определить массовые доли (в %) компонентов сплава. 111. Какой объем при температуре 30оС и давлении 107, 5 кПа займет углекислый газ, выделившийся при полном испарении кусочка сухого льда массой 110 г? 112. При растворении в кислоте металла массой 11, 9 г выделился водород объемом 2, 24 л (н.у.). Чему равна эквивалентная масса металла? 113. Газ (н.у.) занимает объем 1 м3. На сколько градусов следует повысить его температуру, чтобы объем газа утроился, если давление не меняется? 114. Рассчитайте эквивалентную массу кислоты, если на нейтрализацию 0, 009 кг её израсходовано 0, 008 кг гидроксида натрия. 115. Давление воздуха в автомобильной шине равно 3, 0399·105 Па при температуре 15 оС. Как изменится давление в шине при нагревании ее до 60оС от трения при движении автомобиля? Объем считать постоянным. 116. Рассчитайте атомную массу трехвалентного металла, если 3, 36 г этого металла вытесняют из раствора щелочи 4, 244 л водорода при температуре 0оС и давлении 99, 8 кПа. 117. В комнате какого объема находится воздух массой 54 кг при температуре 17оС и давлении 100 кПа? 118. Мышьяк образует 2 оксида, массовая доля мышьяка в которых соответственно равна 65, 22 и 75, 7%. Рассчитайте эквивалентную массу мышьяка в этих оксидах. 119. При температуре 0оС в сосуде объемом 14 л содержится 0, 8 г водорода и 6, 3 г азота. Определите парциальной давление газов и общее давление смеси. 120. 2, 71 г хлорида трехвалентного металла взаимодействуют с 2 г гидроксида натрия. Определите эквивалентную массу соли. Назовите металл, входящий в состав соли. 121. Вычислите массу кислорода, содержащегося в баллоне емкостью 25 л при температуре 20 0С и давлении 121, 6 кПа. 122. Определите эквивалентную массу двухвалентного металла, если для полного сгорания 3, 18 г металла потребовалось 0, 26 л кислорода (н.у.). Какой это металл? 123. При сгорании 2 г магния образовалось 3, 315 г оксид магния. Определить эквивалентную массу магния. 124. В результате реакции 2, 22 г металла с водородом o6paзовалось 2, 54 г гидрида металла. Определить эквивалентную массу металла. 125. При взаимодействии 0, 385 г металла с хлором образовалось 1, 12 г хлорида. Вычислить эквивалентную массу металла, если эквивалентная масса хлора 35, 5 г/моль. 126. Для реакции 0, 44 г металла с бромом потребовало 3, 91 г брома, эквивалентная масса которого 79, 9 г/моль. Определить эквивалентную массу металла. 127. В оксиде свинца содержится 7, 17% кислорода. Определить эквивалентную массу свинца. 128. Хлорид кальция содержит 36, 1% кальция. Вычислить эквивалентную массу кальция, если эквивалентная масса хлора 35, 5 г/моль. 129. Соединение металла с галогеном содержит 64, 5% галогена, оксид того же металла содержит 15, 4% кислорода. Определить эквивалентную массу галогена. 130. Определить эквивалентную массу металла, зная, что его сульфид содержит 77, 85% металла, а эквивалентная масса серы равна 16 г/моль. 131. Один грамм некоторого металла соединяется с 0, 7 г серой или с 3, 47 г брома. Вычислить эквивалентную массу брома и металла, зная, что эквивалентная масса серы равна16 г/моль. 132. Одно и то же количество металла соединяется с 0, 4 г кислорода и с 3, 995 г одного из галогенов. Определить эквивалентную массу галогена. 133. 0, 321 г алюминия и 1, 168 г цинка вытесняют из кислоты одинаковое количество водорода. Найти эквивалентную массу цинка. 134. При разложении 0, 4638 г оксида металла получено 0, 4316 г металла. Определить эквивалентную массу металла. 135. Сколько литров водорода (н.у.) потребуется для восстановления 112 г оксида металла, содержащего 71, 43% металла? Определите эквивалентную массу металла? 136. 13, 07 г двухвалентного металла вытесняют 4, 48 л водорода (н.у.). Вычислить эквивалентную массу металла. 137. Вычислить эквивалентную массу элемента, 0, 5 г которого вытеснили из кислоты при 210С и 101 325 Па 184 мл водорода. 138. 1 г двухвалентного металла вытесняет из кислоты 0, 921 л водорода (н.у.). Вычислить эквивалентную массу металла. 139. 0, 972 г двухвалентного металла вытеснили из кислоты 0, 5 л водорода при 18 0C и 101 325 Па. Вычислить эквивалентную массу металла. 140. Определить эквивалентную массу серной кислоты, если известно, что 98, 08 г ее реагируют с 24, 32 г магния. 141. Определить эквивалентную массу хлорида никеля, если 1, 621 г хлорида взаимодействуют без остатка с 1 г гидроксида натрия. 142. Для нейтрализации щавелевой кислоты гидроксидом калия на 1, 125 г кислоты потребовался 1, 4 г KOH. Вычислить эквивалентную массу кислоты. 143. На нейтрализацию 1, 91 г кислоты израсходовано 1, 245 г гидроксида калия. Вычислить эквивалентную массу кислоты. 144. На нейтрализацию 2 г основания израсходовано 3, 04 г соляной кислоты. Вычислить эквивалентную массу основания. 145. Вычислить эквивалентную массу кислоты, если на нейтрализацию 0, 234 г ее потребовалось 28, 9 мл 0, 1 н. раствора щелочи. 146. В результате реакции 1, 09 г металла с водородом o6paзовалось1, 25 г гидрида. Определить эквивалентную массу металла. 147. При восстановлении водородом 1, 34 г оксида металла до металла образовалось 0, 324 г H2O. Вычислить эквивалентную массу металла. 148. 0, 432 г металла образовали 0, 574 г хлорида. Вычислить эквивалентную массу металла. 149. 0, 493 г хлорида металла после обработки нитратом серебра образовали 0, 861 г AgCl. Вычислить эквивалентную массу металла. 150. На нейтрализацию 0, 73 г кислоты израсходовано 1, 247 г KOH. Вычислить эквивалентную массу кислоты. 151. На нейтрализацию 1, 4 г основания израсходовано 2, 14 г HCl. Вычислить эквивалентную массу основания. 152. Для растворения 16, 8 г металла потребовалось 14, 7 г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (н.у.)
|


 где к- количество катионов или (анионов), z- заряд катионов или (анионов).
где к- количество катионов или (анионов), z- заряд катионов или (анионов).


 = 2 моль.
= 2 моль. = 47, 9 л.
= 47, 9 л.

 кмоль.
кмоль. Sν – ν O2 – ν H2 = 0, 9 -
Sν – ν O2 – ν H2 = 0, 9 -  0, 2 кмоль.
0, 2 кмоль. 0.3304 ∙ 105 Па;
0.3304 ∙ 105 Па;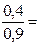 0, 6608 ∙ 105 Па;
0, 6608 ∙ 105 Па;


