Решение типовых задач. Задача 1.Написать выражения закона действующих масс для реакций:
Задача 1. Написать выражения закона действующих масс для реакций: а) 2SO2(Г) + O2(Г) ® 2SO3(Г); б) CaCO3(К) ® CaO(К) + CO2(Г). Решение. а) u = k (СSO2)2× С(Cl2), где u - скорость реакции, моль/л·с; k – константа скорости реакции; С - концентрация вещества, моль/л. б) Поскольку карбонат кальция – твердое вещество, концентрация которого не изменяется в ходе реакции, искомое выражение будет иметь вид: u = k, то есть в данном случае скорость реакции при определенной температуре постоянна. Задача 2. Как изменится скорость реакции: 3H2(Г) + N2(Г) Û 2 NH3(Г) , если а) уменьшить объем реакционного сосуда в 3 раза, б) уменьшить давление в 2 раза. Решение. а) До изменения объема скорость реакции выражалась уравнением: u1 = k (С1(H2))3× С1(N2). Вследствие уменьшения объема концентрация каждого из реагирующих веществ возрастет в 3 раза. Следовательно, теперь u2 = k (3·С1(H2))3× (3·С1(N2)) = 27k (С1(H2))3× С1(N2). Находим отношение скоростей: При уменьшении объема реакционной смеси в 3 раза скорость данной реакции увеличилась в 27 раз. б) До изменения давления скорость реакции выражалась уравнением: u/ = k (С/(H2))3× С/(N2) При уменьшении давления в 2 раза концентрация газообразных веществ также уменьшится в 2 раза. Следовательно: u|| = Находим отношение скоростей: Скорость данной химической реакции при уменьшении давления в 2 раза уменьшится в 16 раз. Задача 3. Температурный коэффициент скорости реакции равен 2, 6. Во сколько раз возрастет скорость реакции при повышении температуры от 15 до 50 0С? Решение. Поскольку Dt = t2 - t1 = 50 – 15 = 35 0C, то, обозначив скорость реакции при 150 и 50 0С соответственно через u1 и u2, можем записать:
Следовательно, скорость реакции возрастет в 28 раз. Задача 4. В системе 2 NO(Г) + O2(Г) Û 2 NO2(Г) равновесные концентрации равны: [NO] = 0, 05 моль/л, [O2] = 0, 12 моль/л, [NO2] = 0, 3 моль/л. Найти константу равновесия реакции и исходные концентрации веществ NO и O2. Решение. Константа равновесия данной реакции выражается уравнением:
Подставляя данные задачи в уравнение, получаем: Для нахождения исходных концентраций NO и O2 учтем, что согласно уравнению реакции из 1 моля O2 и двух молей NO образуется 2 моля NO2. С0(NO)= 0, 05 + 0, 3 = 0, 35 моль/л; С0(O2)= 0, 12 + 0, 3/2 = 0, 28 моль/л. Задача 5. Константа равновесия системы при некоторой температуре равна 0, 5. FeO(k) + CO(Г) Û Fe(k) + CO2(Г). Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составлялиС0(CO) = 0, 05 моль/л, С0 (CO2) = 0, 01 моль/л. Решение. Поскольку FeO и Fe – твердые вещества, их концентрации остаются постоянными и не входят в выражение константы равновесия:
Выразим равновесные концентрации веществ через исходные и уменьшение концентрации СО к моменту наступления равновесия. Пусть х – это уменьшение концентрации СО. Тогда равновесная концентрация [CO] = С0(CO) – x = (0, 05 – x) моль/л. Из уравнения реакции видно, что из одного моля СО образуется 1 моль СО2. Следовательно, равновесная концентрация [CO2] = С0(CO2) + x = (0, 01 + x) моль/л. Для вычисления х подставим числовые значения равновесных концентраций в выражение константы равновесия: [CO2] = С0(CO2) + x = 0, 01 + 0, 01 = 0, 02 моль/л; [CO] = С0(CO) – x = 0, 05 - 0, 01 = 0, 04 моль/л.
601. При 393 К реакция заканчивается за 25 минут. Через сколько времени эта реакция закончится при 443 К, если 602. Для реакции: CO+ H2O Û CO2 + H2, исходные концентрации C0(CO) = C0(H2O) = 0, 3 моль/л. Равновесная концентрация [CO2] = 0, 1 моль/л. Вычислите константу равновесия и равновесные концентрации CO, H2O и H2. 603. Как изменится скорость прямой реакции: 2NO + Cl2 Û 2NOCl, при одновременном увеличении концентрации хлора в 2 раза и концентрации NO в 3 раза? 604. При 80 0С реакция протекает до конца за 10 с. Сколько времени понадобится для той же реакции при 20 0С, если 605. В системе: А + В Û C + D, константа равновесия равна 2, равновесные концентрации веществ А и В соответственно равны 2 и 8 моль/л. Вычислите равновесные концентрации веществ С и D. 606. Как надо изменить давление в газовой системе: 2HCl Û H2 + Cl2, чтобы скорость прямой реакции возросла в 36 раз? 607. Для газовой системы: 4HCl + O2 Û 2H2O + 2Cl2 вычислите константу равновесия и начальные концентрации исходных веществ, если в момент равновесия: [H2O] = [Cl2] = 0, 28; [HCl] = 0, 36; [O2] = 0, 64 моль/л. 608. При повышении температуры с 30 до 90 0С скорость реакции возросла в 350 раз. Чему равен температурный коэффициент скорости реакции? 609. Вычислите константу равновесия и начальные концентрации исходных веществ для реакции: N2 + 3H2 Û 2NH3, если к моменту равновесия концентрации веществ были: [N2] = 0, 1 моль/л; [H2] = 0, 3 моль/л; [NH3] = 0, 5 моль/л. 610. В системе: A2 + 3B2 Û 2AB3, концентрацию A2 увеличили с 0, 1 до 0, 5 моль/л, а концентрацию B2 с 0, 4 до 0, 8 моль/л. Как при этом изменилась скорость прямой реакции? 611. В системе: 2NO2 Û 2NO + O2 равновесные концентрации исходных веществ составляют: [NO2] = 0, 06 моль/л; [NO] = 0, 24 моль/л; [O2] = 0, 12 моль/л. Определите константу равновесия и исходную концентрацию NO2. 612. Равновесие в системе: 2Cl2 + 2H2O Û 4HCl +O2, установилось при следующих концентрациях: [Cl2] = 0, 8 моль/л; [H2O] = 2, 2 моль/л; [HCl] = 1, 2 моль/л; [O2] = 0, 3 моль/л. Вычислите константу равновесия и исходные концентрации Cl2 и H2O. 613. Равновесные концентрации участников реакции: Сl2 + CO Û COCl2 были равны: [Cl2] = 5 моль/л; [CO] = 4 моль/л; [COCl2] = 6, 4 моль/л. Определите исходные концентрации Cl2 и CO. 614. Как изменится скорость реакции при изменении температуры с 20 до 60 0С, если γ = 2, 5? 615. Сколько молей HI образуется в системе: H2 + I2 Û 2HI из 1 моля I2 и 2 молей H2, если константа равновесия равна 50? 616. При 20 0С реакция заканчивается за 45 минут. Сколько времени понадобится для этой же реакции при 5 0С, если 617. Как изменится скорость химической реакции при понижении температуры с 90 до 15 0С, если температурный коэффициент скорости реакции равен 2, 3? 618. Определите равновесную концентрацию водорода в системе: 2HCl Û H2 + Cl2, константа равновесия которой равна 0, 2, а исходная концентрация HCl была равна 0, 5 моль/л. 619. Как изменится скорость химической реакции при понижении температуры на 25 0С, если температурный коэффициент равен 2, 5? 620. В системе: 2NO + Cl2 Û 2NOCl, исходные концентрации составляют: C0(NO) = 0, 5 моль/л; C0(Cl2)= 0, 2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO. 621. Во сколько раз увеличится константа скорости химической реакции при повышении температуры на 40 0С, если 622. Константа равновесия системы: 2PbS(т) + 3O2(г) Û 2PbO(т) + 2SO2(г) равна 0, 54. Равновесная концентрация SO2 равна 1, 35 моль/л. Определите концентрацию О2 в момент, когда концентрация SO2 будет равна 0, 35 моль/л. 623. Константа равновесия системы: CO + H2O Û H2 + CO2 при некоторой температуре равна 1. Равновесные концентрации: [H2O] = 0, 6 моль/л; [H2] = 0, 8 моль/л; [CO2] = 0, 8 моль/л. Определите исходную концентрацию оксида углерода (II). 624. Вычислите температурный коэффициент реакции, если константа её скорости при 120 0С составляет 5, 88 · 10-4, а при 170 0С – 6, 7 · 10-2. 625. Константа равновесия системы: 2HI Û H2 + I2, равна 0, 12. Определите равновесные концентрации реагирующих веществ, если объём реакционного сосуда равен 10 л и в него было введено 5 моль HI. 626. Как изменится скорость химической реакции газов при увеличении давления в системе в 3 раза: а) 2 А + В2 Û 2 АВ; б) А2 + В2 Û 2 АВ; в) 2 АВ2 Û А2В4. 627. Реакция протекает по уравнению: 2А Û В. Исходная концентрация вещества А равна 0, 5 моль/л; константа равновесия реакции равна 0, 5. Найдите равновесные концентрации обоих веществ. 628. При повышении температуры на 20 0С скорость некоторой химической реакции увеличилась в 9 раз. Чему равен температурный коэффициент этой реакции и во сколько раз увеличится её скорость при повышении температуры на 100 0С. 629. Равновесие в системе: 2Cl2 + 2H2O Û 4HCl +O2, установилось при следующих концентрациях: [Cl2] = 0, 8 моль/л; [H2O] = 2, 2 моль/л; [HCl] = 1, 2 моль/л; [O2] = 0, 3 моль/л. Вычислите константу равновесия и исходные концентрации Cl2 и H2O. 630. Как изменится скорость прямой реакции: А(г) + В(г) Û С(г), если увеличить давление в системе в 3 раза и одновременно повысить температуру на 40 0С ( 631. Равновесные концентрации участников реакции: Сl2 + CO Û COCl2 были равны: [Cl2] = 5 моль/л; [CO] = 4 моль/л; [COCl2] = 6, 4 моль/л. Определите исходные концентрации Cl2 и CO. 632. Как изменится скорость реакции при изменении температуры с 20 до 60 0С, если γ = 2, 5? 633. Константа химического равновесия реакции: N2 + 3H2 Û 2NH3 равна 0, 1 л2/моль2. Равновесные концентрации: [H2] = 3 моль/л; [NH3] = 9 моль/л. Вычислите исходную и равновесную концентрацию азота. 634. Во сколько раз следует увеличить концентрацию водорода в системе: N2+ 3H2 Û 2NH3, чтобы скорость прямой реакции возросла в 100 раз? 635. Определите температурный коэффициент скорости химической реакции, если при понижении температуры на 45 0С реакция замедлилась в 30 раз. 636. Реакция протекает по уравнению: 4NH3 + 5O2 Û 4NO + 6H2O. Через некоторое время после начала реакции концентрации участников реакции были: [NH3] = 0, 9 моль/л; [О2] = 2 моль/л; [NO] = 0, 3 моль/л. Вычислите концентрацию воды в этот момент, а также и начальные концентрации аммиака и кислорода. 637. Константа скорости реакции: 2N2O Û 2N2 + O2 равна 5× 10-4 л/моль× мин, а начальная концентрация N2O равна 6 моль/л. Определите скорость реакции в начальный момент и в тот момент, когда разложится 80 % оксида азота (I). 638. Как изменится скорость реакции: N2 + 3H2 Û 2NH3, если концентрацию азота увеличить в 3 раза, а водорода – в 5 раз? 639. Константа скорости реакции: А + 2В Û 3С равна 0, 6 л2/моль2× с. Начальная концентрация C0(А) = 5 моль/л; C0(В) =3 моль/л. Определите концентрацию вещества А и скорость реакции в момент, когда концентрация вещества В будет равна 1 моль/л. 640. На сколько градусов необходимо повысить температуру, чтобы скорость реакции возросла в 50 раз, если γ = 2, 3? 641. Равновесие реакции: СО + Cl2 Û СOCl2 установилось при следующих концентрациях участников реакции: [CO]=[Cl2]= [COCl2] = 0, 001 моль/л. Найти константу равновесия и исходные концентрации CO и Cl2. 642. Газовая реакция протекает по уравнению: N2 + O2 Û 2NO. Как изменится скорость прямой реакции: а) при увеличении концентрации N2 и О2 в 2 раза; б) при уменьшении давления в 3 раза? 643. Вычислить начальные концентрации азота и водорода в реакции: N2 + 3H2 Û 2H3, если в состоянии равновесия концентрации участников реакции были: [N2]=0, 01моль/л; [H2]=3, 6 моль/л; [NH3]=0, 4 моль/л. 644. В гомогенной системе: А + В Û С + Д равновесие установилось при концентрациях (моль/л): [В] = 0, 05; [Д]=[C] = 0, 02. Константа равновесия системы равна 0, 04. Вычислите исходные концентрации веществ А и В. 645. Определить скорость реакции: 2N2O Û 2N2 + O2, в начальный момент времени и когда разложится 50% N2O, если k = 5·10-4 л/моль и концентрация С0(N2O) = 6 моль/л. 646. Как изменится скорость гомогенной газовой реакции: 2SO2 + O2 Û 2SO3, если: а) уменьшить объем газовой смеси в 4 раза; б) увеличить концентрацию SO2 в 3 раза? 647. Как изменится скорость газовой реакции: N2 + 3H2 Û 2NH3, если: а) увеличить давление в 3 раза; б) уменьшить концентрацию H2 в 2 раза? 648. В гомогенной газовой системе: СO + H2O Û CO2 + H2 равновесие установилось при следующих концентрациях: [CO]= 0, 0025 моль/л, [H2O]=0, 022 моль/л, [H2]=[CO2]=0, 0075 моль/л. Рассчитать константу равновесия и исходные концентрации СО и Н2О. 649. Напишите выражение для константы равновесия гомогенной системы: N2+3H2Û 2NH3. Как изменится скорость прямой реакции – образования аммиака, если увеличить концентрацию водорода в 3 раза? 650. В реакции H2 + I2 Û 2HI исходные концентрации H2 и I2 равны, каждая по 1 моль/л. Вычислить равновесные концентрации веществ, если константа равновесия равна 50. 651. При повышении температуры на 80 К скорость реакции увеличилась в 500 раз. Рассчитайте температурный коэффициент скорости реакции. 652. Напишите выражение для константы равновесия гомогенной системы: N2 +3H2 Û 2NH3. Как изменится скорость прямой реакции – образования аммиака, если увеличить концентрацию водорода в 5 раз? 653. Равновесные концентрации в гомогенной газовой системе: 2SO2 + O2 Û 2SO3 составляли: [SO2]=0, 04 моль/л, [O2]=0, 06моль/л, [SO3]=0, 02моль/л. Вычислить константу равновесия и исходные концентрации SO2 и О2. 654. Вычислить константу равновесия газового процесса: PCl5 Û PСl3 + Cl2, если из 3 молей находящихся в закрытом сосуде емкостью 10 л, подвергаются разложению 2, 5 л. 655. Равновесие в гомогенной газовой системе: СО2 + Н2 Û СО + Н2О, установилось при концентрациях: [CO2] = 0, 004 моль/л, [H2] = 0, 001 моль/л, [CO]= 0, 02 моль/л, [H2O]= 0, 02 моль/л. Вычислить константу равновесия и исходные концентрации СО2 и Н2. 656. Вычислите, во сколько раз возрастет скорость реакции при повышении температуры с 20 до 400. Температурный коэффициент скорости равен g = 3, 8. 657. Как изменится скорость газовой реакции: 4CO + 2SO2 Û S2 + 4CO2, если: а) увеличить давление в 2 раза; б) уменьшить концентрацию СО2 в 3 раза? 658. Константа равновесия гомогенной газовой реакции: СО + H2O Û CO2 + H2, при 10900С равна 10, 51. Найти концентрации всех веществ в момент равновесия, если в реакцию вступают по 1 молю СО и Н2О. 659. Смешивают 2 л вещества А и 3 л вещества В. Концентрация А до смешения равна 0, 5 моль/л, концентрация В — 1 моль/л. Каковы концентрации вещества А и В в первый момент после смешения? 660. Во сколько раз необходимо увеличить концентрацию диоксида углерода, чтобы скорость реакции CO2(г) + C(т) Û 2CO(г) возросла в 9 раз? 661. В начальный момент протекания реакции: N2 + 3H2 Û 2NH3 концентрации были равны (в моль/л ): C0(N2) = 1, 2; C0(H2) = 2, 2. Чему равны концентрации азота и водорода в момент достижения концентрации аммиака 0, 4 моль/л? 662. Начальные концентрации исходных веществ реакци СО (г) + Н2О (г) Û СО2 (г) + Н2 (г) были равны: C0(CO) = 0, 1 моль/л; C0(H2O) = 0, 15 моль/л.. Вычислите концентрации всех участников реакции в момент, когда прореагировало 20% СО. 663. При 303 К реакция заканчивается за 5 минут. Через сколько времени эта реакция закончится при 443 К, если 664. Реакция протекает по уравнению Na2S2O3 + H2SO4 = Na2SO4 + H2SO3 + S. Как изменится скорость реакции после разбавления реагирующей смеси в 4 раза? 665. Реакция протекает по уравнению 2А Û В. Исходная концентрация вещества А равна 0, 2 моль/л. Константа равновесия реакции 0, 5. Вычислите равновесные концентрации реагирующих веществ. 666. Две реакции при 283К протекают с одинаковой скоростью. Температурный коэффициент скорости первой и второй реакции равны соответственно 2, 5 и 3, 0. Как будут относится скорости реакций, если первую из них провести при 350 К, а вторую при 330К? 667. В начальный момент протекания реакции N2 + 3H2 Û 2NH3 концентрации были равны (моль/л): азота - 1, 5; водорода - 2, 5. Каковы концентрации азота и водорода при концентрации аммиака равной 0, 5 моль/л? 668. Константа равновесия реакции Н2 + Вr2 Û 2НВr равна 1. Определите состав равновесной смеси, если для реакции были взяты 1 моль водорода и 2 моль брома. 669. Для практической остановки реакции применяют быстрое охлаждение реакционной смеси. Определите во сколько раз изменится скорость реакции при охлаждении реакционной смеси с 40 0С до -10 0С, если температурный коэффициент реакции равен 2, 7. 670. На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2, 7. 671. Определите равновесные концентрации йода и водорода в реакции: 2HI Û H2 + I2, если исходная концентрация HI составляет 0, 55 моль/л, а константа равновесия равна 0, 12. 672. Вычислите при какой температуре реакция закончится за 45 минут, если при 293 К на это требуется 3 часа. Температурный коэффициент равен 3, 2. 673. При синтезе фосгена имеет место равновесие реакции: Сl2 + CO Û COCl2. Определите исходные концентрации хлора и оксида углерода, если равновесные концентрации в моль/л равны: [ Cl2] = 2, 5; [CO] = 1, 8; [COCl2] = 3, 2 674. Начальные концентрации веществ в реакции СО + Н2О Û СО2 + Н2 были равны (моль/л): С0(СО) = 0, 05; С0(Н2Огаз) = 0, 06. Вычислите концентрации всех реагирующих веществ после того как прореагировало 60% Н2О. 675. Реакция идет по уравнению 4NH3 + 5O2 Û 4NO + 6H2O. Как изменится скорость реакции, если увеличить давление в 2 раза? 676. В каком направлении сместится равновесие реакции 2СО + 2Н2 Û СН4 + СО2, если концентрации всех реагирующих веществ уменьшить в 3 раза? 677. Равновесие в системе 2NO2 = 2NO + O2 при некоторой температуре установилось при концентрациях в моль/л: [ NO2] = 0, 06; [NO] =0, 24; [O2] = 0, 12. Определите константу равновесия и рассчитайте исходную концентрацию NO2. 678. Определите равновесные количества веществ, если константа равновесия реакции СО2 + Н2 Û СО + Н2О(г), при некоторой температуре равна 1 и для реакции было взято 1 моль углекислого газа и 3 моль водорода. 679. Определите температурный коэффициент скорости реакции, если при понижении температуры на 45 0С реакция замедлилась в 30 раз. 680. Напишите выражение для константы равновесия гомогенной системы N2 + 3H2 Û 2NH3. Как изменится скорость прямой реакции – образования аммиака, если увеличить концентрацию водорода в 3 раза? 681. Определите на сколько градусов была повышена температура, если скорость реакции возросла в 1000 раз, а температурный коэффициент скорости равен 3, 3? 682. В гомогенной системе А + 2В Û С равновесные концентрации реагирующих газов (моль/л): [А] = 0, 06; [В] = 0, 12; [C] = 0, 216. Вычислите константу равновесия системы и исходные концентрации веществ А и В. 683. Определите, как изменится скорость гетерогенной реакции: С2Н5ОН (ж) + 3О2 (г) = 2СО2 (г) + 3H2О (ж), если давление увеличить в три раза? 684. Вычислите во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 80 до 132 0С? Температурный коэффициент скорости равен 4, 2. 685. Реакция идет по уравнению N2 + О2 Û 2NО. Концентрация исходных веществ до начала реакции были C0(N2) = 0, 049моль/л, C0(О2)= 0, 01 моль/л. Вычислите концентрацию этих веществ, когда [NО] = 0, 005 моль/л. 686. Рассчитайте, как изменится скорость прямой и обратной реакций при увеличении давления в 3 раза в гомогенной системе: N2 + 2О2 Û 2NО2. 687. При некоторой температуре равновесные концентрации в системе: 2NO + О2 Û 2NO2 составили соответственно: [NO] = 0, 04 моль/л, [О2] = 0, 06 моль/л, [NO2] = 0, 02 моль/л. Вычислить константу равновесия и исходные концентрации NO и О2. 688. В гомогенной газовой системе: COCl2 Û CO + Cl2 равновесные концентрации реагирующих веществ (моль/л): [COCl2] = 1, 8; [CO] = 0, 5; [Cl2] = 0, 7. Вычислите константу равновесия системы и исходную концентрацию COCl2. 689. При увеличении температуры на 50 °С скорость реакции возросла в 32 раза. Вычислить температурный коэффициент реакции. 690. Гомогенная газовая реакция протекает по уравнению: I2 + H2 Û 2НI. Константа скорости этой реакции при некоторой температуре равна 0, 16. Исходные концентрации реагирующих веществ равны: C0(I2) = 0, 05 моль/л, C0(Н2) = 0, 04 моль/л. Вычислите начальную скорость реакции и ее скорость при [Н2] = 0, 03 моль/л. 691. Вычислить константу равновесия газовой реакции СО + Н2О Û СО2 + Н2, если равновесные концентрации реагирующих веществ (моль/л): [Н2О] = 0, 064; [СО] = 0, 004; [Н2] = 0, 016; [СO2] = 0, 016.Вычислите исходные концентрации воды и СО? 692. Скорость некоторой реакции увеличивается в 2, 5 раза при повышении температуры на каждые 10 °С в интервале от 0 до 60 °С. Во сколько раз увеличится скорость при повышении температуры от 20 до 45 °С? 693. Реакция идет по уравнению N2 + 3H2 Û 2NH3 начальные концентрации исходных веществ были С0(N2) = 0, 8 моль/л, С0(Н2) = 1, 5 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0, 5 моль/л. 694. В реакции С(т) + 2Н2(г) Û СН4(г) концентрация водорода увеличилась в 2 раза. Во сколько раз возрастет скорость реакции? 695. Напишите выражение для константы равновесия гетерогенной реакции: С(т) + Н2О(г) Û СО(г) + Н2(г). Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров? 696. Растворение образца цинка в соляной кислоте при 20 0С заканчивается через 27 минут, а при 40 0С такой образец металла растворяется за 3 минуты. За какое время данный образец цинка растворится при 55 0С? 697. Почему при изменении давления смещается равновесие системы N2 + 3H2 Û 2NH3 и не смещается равновесие системы N2 + О2 Û 2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакций в этих системах до и после изменения давления. Напишите выражение для константы равновесия каждой из данных систем. 698. Исходные концентрации оксида углерода (II) и паров воды равны 0, 05 моль/л. Вычислите равновесные концентрации СО, Н2О и Н2 в гомогенной газовой системе: СО + Н2О Û СО2 + Н2, если равновесная концентрация СО2 равнялась 0, 01 моль/л, вычислите константу равновесия. 699. Константа скорости газовой реакции разложения N2O, протекающей по реакции: 2N2O Û 2 N2 + О2 равна 5·10-4. Начальная концентрация N2O равна 6, 0 моль/л. Вычислите начальную скорость реакции и ее скорость, когда разложится 50 % N2O. 700. Как изменится скорость прямой и обратной реакции в гомогенной системе: 2SO2(г) + О2(г) Û 2S0з(г), если давление увеличить в два раза? 701. Напишите выражение для константы равновесия гетерогенной реакции: СО2(г) + С(к) Û 2СО(к). Как изменится скорость прямой реакции – образования СО, если концентрация СО2 уменьшить в 6 раз? Как следует изменить давление, чтобы повысить выход СО? 702. Гомогенная газовая реакция протекает по уравнению: 4NH3 + 5О2 Û 4NO + 6Н2О. Как изменится скорость прямой и обратной реакций, если давление увеличить в два раза? 703. Равновесие гомогенной газовой системы 2NO + О2 Û 2NО2 установилось при следующих равновесных концентрациях реагирующих веществ (моль/л): [NO] = 0, 2; [NО2] = 0, 1; [О2] = 0, 1. Вычислите константу равновесия и исходную концентрацию NO и О2. 704. Указать, какими изменениями концентраций реагирующих веществ можно сместить вправо равновесие реакции: СО2(г) + С(графит) Û 2СО(г). 705. Равновесие гомогенной газовой системы 4НСl + O2 Û 2Н2О + 2Cl2 установилось при следующих концентрациях реагирующих веществ (моль/л): [Н2О] = 0, 14; [НСl] = 0, 2; [Cl2] = 0, 14; [O2] = 0, 32.Вычислите исходные концентрации хлороводорода и кислорода. 706. Как изменится скорость образования оксида азота (IV) в соответствии с реакцией: 2NO(г) +O2 (г) Û 2NO2(г), если давление в системе увеличить в 4 раза, температура остается неизменной? 707. Исходные концентрации NO и Cl2 в гомогенной газовой системе: 2NO + Cl2 Û 2 NOCl составляют соответственно 0, 5 и 0, 2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 25 % NO. 709.Система: С(графит) + СО2(г) Û 2СО(г), Δ Н0 = 172, 5 кДж находится в состоянии равновесия. Укажите: а) изменится ли константа равновесия при повышении общего давления и неизменной температуре, б) при увеличении температуры, в) при введении в систему катализатора? 710.Константа равновесия гомогенной газовой системы СО + Н2О Û О2 + Н2 при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации равны (моль/л): С0(Н2О) = 0, 4; С0(СО) = 0, 1. 711.Концентрация аммиака в замкнутом сосуде при 0 °С равна 1 моль/л. При нагревании сосуда до 546 °С давление внутри увеличилось в 3, 3 раза. Определите константу равновесия для реакции разложения аммиака при 546°С. 712. Константа равновесия гомогенной газовой системы: N2 + 3H2 Û 2NH3 при некоторой температуре равна 0, 1. Равновесные концентрации водорода и аммиака соответственно равны 0, 2 и 0, 08 моль/л. Вычислите равновесную и исходную концентрации азота. 713. В каком направлении сместиться равновесие реакции А2(г) + В2(г) Û 2АВ(г), если давление увеличить в 2 раза и одновременно повысить температуру на 10 градусов? Температурные коэффициенты скорости прямой и обратной реакции равны соответственно 2 и 3. Каков знак DН0 этой реакции? 714. В гомогенной системе: А + В Û С равновесие установилось при концентрациях (моль/л): [В] = 0, 25; [C] = 0, 02. Константа равновесия системы равна 0, 5. Вычислите исходные концентрации веществ А и В. 715. Система С(графит) + СО2(г) Û 2СО(г), DН = 172, 5 кДж находится в состоянии равновесия. Укажите: а) как изменится содержание СО в равновесной системе с повышением температуры при неизменном давлении? б) с ростом общего давления при неизменной температуре? 716. При повышении температуры на 40 оС скорость реакции возросла 25 раз. Чему равен температурный коэффициент скорости? 717. Для равновесных систем: а) 2 H2S(г) + 3 O2(г) Û 2 SO2(г) + 2 H2O(г) б) 2 P(к) + 3 H2(г) Û 2 PH3(г) в) CuO(к) + C(к) Û CO(г) + Cu(к) напишите выражение констант равновесия и укажите, как сместится равновесие в системах при уменьшении давления. 718. Для реакции 2А + В Û С константа скорости равна 0, 8. Исходные концентрации веществ А и В равны соответственно 2, 5 и 1, 5 моль/л. В результате реакции концентрация вещества В стала 0, 5 моль/л. Вычислите скорость реакции и конечные концентрации веществ А и С. 719. При некоторой температуре равновесные концентрации в системе: 2SO2 + О2 Û 2SO3 составили: [SO2] = 0, 4 моль/л, [О2] = 0, 6 моль/л, [SO3] = 0, 2 моль/л. Вычислите константу равновесия и начальные концентрации исходных веществ. 720. Как надо изменить давление в системе 2HCl Û H2 + Cl2, чтобы скорость реакции возросла в 32 раза? 721. Для системы 4НCl + O2 Û 2H2O + 2Cl2 вычислить константу равновесия и начальные концентрации исходных веществ, если в момент равновесия [H2O] = [Cl2] = 0, 28; [HCl] = 0, 4; [О2] = 0, 64 моль/л. 722. В системе 2NO + Cl2 Û 2NOCl исходные концентрации составляют С0(NO) = 0, 45 моль/л и С0(Cl2) = 0, 225 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 35% NO. 723. Вычислить, во сколько раз возрастет скорость реакции при повышении температуры с 20 до 40°. Температный коэффициент скорости равен 3. 724. Смешивают 2 л вещества А и 3 л вещества В. Концентрация А до смешения равна 0, 5 моль/л, концентрация B – 1 моль/л. Каковы концентрации вещества А и В в первый момент после смешения? 725. 2, 5 л раствора содержат 2 моля вещества А и 0, 5 моля вещества В. Каковы концентрации А и В после разбавления раствора вдвое? 726. Реакция протекает по схеме 2А + 3В Û С. Концентрация А уменьшилась на 0, 1 моль/л. Каково при этом изменение концентрации вещества В? 727. Начальные концентрации веществ, участвующих в реакции СО + H2O Û CO2 + H2, были равны (моль/л): C0(СO) = 0, 3; С0(Н2О) = 0, 4. Каковы концентрации всех веществ в момент, когда прореагировала третья часть оксида углерода (II)? 728. Вычислить константу равновесия и начальные концентрации веществ А и В реакции 2А(г) + В(г) Û 2С(г), если равновесные концентрации веществ равны (моль/л): [А] = 0, 12; [В]= 0, 24; [C] = 0, 295. 729. Равновесие в реакции 2NO2Û 2NO + O2 установилось при концентрациях (моль/л): [NO2] = 0, 02; [NO] = 0, 16; [O2] = 0, 08. Вычислить константу равновесия этой реакции и начальные концентрации исходных веществ. 730. Вычислить константу равновесия и начальные концентрации исходных веществ обратимой реакции CO2 + H2 Û CO+H2O, если при равновесии концентрации (моль/л) всех веществ оказались следующими: [CO2]=0, 02; [H2]=0, 005; [СО] =0, 015; [H2O] =0, 015. 731. Реакция СО + Cl2 Û COCl2 протекает в объеме 10 л. Состав равновесной смеси 14 г СО; 35, 5 г Cl2 и 49, 5 г COCl2. Вычислить константу равновесия реакции и начальные концентрации исходных веществ. 732. Начальные концентрации веществ, участвующих в реакции N2 + 3H2 Û 2NH3, равны (моль/л): C0(N2) = 0, 2; C0(Н2) = 0, 3. Каковы концентрации азота и водорода в момент, когда концентрация аммиака станет равной 0, 1 моль/л? 733. Написать выражение скорости химической реакци протекающей в гомогенной системе по схеме А + 2В Û С, и определить во сколько раз увеличится скорость реакции, если а) концентрация А увеличится в 2 раза; б) концентрация В увеличится в 3 раза; в) концентрации А и В увеличатся в 2 раз 734. Во сколько раз необходимо увеличить концентрацию диоксида углерода, чтобы скорость реакции CO2 + C Û 2CO возросла в 3 раза? 735. Во сколько раз следует увеличить давление, чтобы скорость образования NO2 по реакции 2NO + O2 Û 2NO2 возросла в 1000 раз? 736. Реакция идет по уравнению H2+ I2 Û 2НI. В некоторый момент времени концентрации были: [H2] = 0, 049; [I2] = 0, 024 и [HI] = 0, 01 моль/л. Найти концентрации участвующих в реакции веществ в момент, когда концентрация водорода уменьшится на 0, 012 моль/л. 737. Начальные концентрации в реакции СО + H2O Û CO2 + H2 равны (моль/л): С0(СО) = 0, 2; С0(Н2О)= 0, 4. Вычислить концентрации всех участвующих в реакции веществ после того, как прореагировало 40% СО. 738. Как надо повысить давление в некоторой газовой химической системе А + В → С для того, чтобы скорость реакции образования вещества С возросла в 32 раза? 739. Константа скорости реакции 2А + В Û С равна 0, 8. Начальные концентрации: С0(А) = 2, 5 моль/л и С0(В) = 1, 5 моль/л. В результате реакции концентрация вещества [В] оказалась равной 0, 5 моль/л. Вычислить, чему стала равна концентрация вещества [А] и скорость реакции. 740. К некоторому моменту времени скорость реакции А + В Û С уменьшилась в 100 раз. Как изменились концентрации веществ А и В (начальные концентрации веществ А и В были равны между собой)? 741. Как изменится скорость реакции, Na2S2O3 +H2SO4 Û Na2SO4 + H2SO3 + S, если: а) реагирующую смесь разбавить в три раза; б) повысить концентрацию Na2S2O3 в два раза, а концентрацию серной кислоты – в три раза; в) понизить концентрацию Na2S2O3 в два раза, а серной кислоты – повысить в два раза. 742. В сосуд объемом 0, 5 л помещено 0, 5 моля водорода 0, 5 моля азота. К моменту равновесия образовалось 0, 02 моля аммиака. Вычислить константу равновесия. 743. Вычислить константу равновесия реакции Н2 + I2Û 2НI происходящей в сосуде объемом 2 л, если начальные количества веществ были следующие: 0, 2 г H2 и 12, 7 г I2 и к момент равновесия прореагировало 20% водорода. 744. Вычислить равновесные концентрации H2 и I2, реакции Н2 + I2Û 2НI, если их начальные концентрации составляли 0, 5 и 1, 5 моль/л соответственно, а равновесная концентрация [HI] = 0, 8 моль/л. Вычислить константу равновесия. 745. Вычислить равновесные концентрации H2 и I2 в реакции Н2 + I2 Û 2НI, если их начальные концентрации составляли по 0, 08 моль/л, а равновесная концентрация [HI] = 0, 04 моль/л. Вычислить константу равновесия. 746. Вычислить начальные концентрации хлора и оксид углерода (II), константу равновесия реакции: CO + Cl2Û COCl2, если равновесные концентрации (моль/л) [Cl2] =0, 3; [СО] =0, 2; [COCl2] = 1, 5. 747. Равновесные концентрации веществ в реакции 2SO2+O2Û 2SO3 составляют (моль/л): [SO2] =0, 0002; [O2] =0, 004; [SO3] =0, 003. Вычислить исходные концентраци кислорода и диоксида серы. Вычислить константу равновесия. 748. Равновесные концентрации веществ в обратимой реакции N2+3H2Û 2NH3 составляют (моль/л): [N2] = 4; [H2] = 9; [NH3] = 6. Вычислить исходные концентрации азота и водорода и константу равновесия. 749. Вычислить равновесные концентрации веществ в реакции Н2 + I2Û 2НI, если начальные концентрации водорода и йода составляли 1, 0 и 0, 6 моль/л соответственно и известно, что в реакцию вступило 50% водорода. Вычислить константу равновесия. 750. Оксид углерода (II) и хлор были помещены в закрытый сосуд при постоянной температуре. Начальные их концентрации равны 1 моль/л, давление в сосуде равно 101 325 Па. В результате реакции СО+С12Û СОС12 к моменту равновесия осталось 50% СО. Каково давление в сосуде при равновесии? 751. Как изменится давление при наступлении равновесия в реакции N2 + 3H2Û 2NH3, протекающей в закрытом сосуде при постоянной температуре, если начальные концентрации азота и водорода составляют соответственно 2 и 6 моль/л и если равновесие наступает тогда, когда прореагирует 10% первоначального количества азота? 752. Вычислить процент разложения молекулярного хлора на атомы, если константа равновесия составляет 4, 2× 10-4, а исходная концентрация хлора 0, 04 моль/л. С12Û 2С1. 753. Пентахлорид фосфора диссоциирует при нагревании по уравнению РС15Û РС13+С12. Вычислить константу равновесия этой реакции, если из 3 молей PCl5, находящихся в закрытом сосуде емкостью 10 л, подвергаются разложению 2, 5 моля. 754. При некоторой температуре равновесные концентрации в системе: 2SO2 + O2 Û 2SO3 составил
|


 .
. .
. .
. ;
;  ;
; 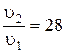 .
.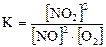 .
. .
. .
. ; х = 0, 01 моль/л.
; х = 0, 01 моль/л. = 2, 5?
= 2, 5? = 2, 1?
= 2, 1? = 3, 2?
= 3, 2?


