Решение типовых задач. Задача 1.Сколько граммов и молей вещества содержится в 100 мл 21% (по массе) раствора NaOH (ρ = 1,23 г/мл)?
Задача 1. Сколько граммов и молей вещества содержится в 100 мл 21% (по массе) раствора NaOH (ρ = 1, 23 г/мл)? Решение. Найдём массу раствора: mр-ра = V·ρ = 100 · 1, 23 = 123 г. Из формулы массовой доли выразим и найдём массу вещества: Молярная масса NaOH равна 40 г/моль. Следовательно, число молей NaOH в растворе составит: Задача 2. В 370 мл воды растворили 30 г медного купороса CuSO4· 5H2O. Найдите масоовую долю сульфата меди в полученном растворе. Решение. Плотность воды равна 1 г/мл, тогда её масса: mводы = 370· 1 = 370г. Находим массу полученного раствора: mр-ра = mв-ва + mводы= 370 + 30=400 г. Определяем массу безводного CuSO4 в 30 г медного купороса. Молярная масса CuSO4· 5H2O равна 250 г/моль. Молярная масса CuSO4 равна 160 г/моль. В 250 г CuSO4· 5H2O содержится 160 г CuSO4; В 30 г CuSO4· 5H2O содержится х г CuSO4.
Таким образом, в растворе содержится 19, 2 г безводного CuSO4. Рассчитываем массовую долю раствора:
Задача 3. К 200 мл 35 % (по массе) раствора NaOH (ρ = 1, 38 г/мл) добавили 500 мл воды. Определите массовую долю полученного раствора. Решение. Определим массу исходного раствора: mр-ра = V·ρ = 200·1, 38=276 г Найдём массу вещества в этом растворе:
В исходном растворе содержится 96, 6 г NaOH. Такое же количество будет содержаться в растворе после его разбавления. Определим массу полученного раствора: mр-ра = 276 + 500 = 776 г. Зная массу раствора и содержание в нём растворённого вещества, найдём масоовую долю полученного раствора NaOH:
Задача 4. Сколько граммов серной кислоты содержится в 400 мл 2 М раствора? Чему равны нормальность и титр этого раствора? Решение. Молярная масса сернойкислоты равна 98 г/моль. Переводим объём раствора в литры Vр-ра = 400 мл = 0, 4 л и находим массу серной кислоты: mв = СM · Vр-ра · M = 2 · 0, 4 · 98 = 78, 4 г. Находим эквивалентную массу H2SO4: Определяем нормальность раствора: Зная молярную концентрацию раствора, нормальную можно найти и другим способом. Т.к. молярная масса больше эквивалентной в (k · z) число раз, то эквивалентная концентрация во столько же раз больше молярной: СН = СМ · (k · z) = 2 · 2 · 1 = 4 моль/л. Находим титр раствора:
Задача 5. Вычислите эквивалентную концентрацию 49% (по массе) раствора H3PO4 (ρ = 1, 33 г/мл). Решение. Молярная масса фосфорной кислоты равна 98 г/моль. Её эквивалентная масса: Пусть объём раствора равен 1 л (1000 мл), тогда его масса: mр-ра = V·ρ = 1000 · 1, 33 = 1330 г. Зная массовую долю раствора, найдём массу вещества, содержащегося в 1 л раствора: Определяем нормальность раствора:
757. К 950 г воды прибавили 50 мл 48%-ного раствора H2SО4 (ρ = 1, 38 г/мл). Вычислить массовую долю H2SO4 в полученном растворе. 758. Сколько литров 2, 5 %-ного раствора NaOH (ρ = l, 03 г/мл) можно приготовить из 80 мл 35%-ного раствора (ρ = l, 38 г/мл)? 759. Смешаны 400 мл 1, 2 М раствора NaOH и 600 мл 1, 8 М раствора NaOH. Определите молярность полученного раствора. 760. Определите молярную и нормальную концентрацию 61, 4 % (по массе) раствора MgSO4 ( 761. Титр раствора серной кислоты H2SO4 равен 0, 0049 г/мл. Какова нормальность этого раствора? 762. Какую массу металлического висмута можно растворить в 30 мл 20% (по массе) раствора HNO3 ( 763. Смешали 2 л 10%-ного и 4 л 24%-ного раствора азотной кислоты. Чему равна массовая доля полученного раствора? 764. На нейтрализацию 20 мл 1 н. раствора гидроксида натрия пошло 20 мл раствора серной кислоты. Чему равна нормальность раствора кислоты? 765. На нейтрализацию 40 мл 0, 1 н раствора азотной кислоты пошло 4 мл раствора гидроксида калия. Чему равна нормальность раствора щелочи? 766. На нейтрализацию 60 мл 0, 25 н. H2SO4 пошло 180 мл раствора KOH. Чему равны нормальность и титр раствора KOH? 767. Для нейтрализации 20 мл 0, 1 н. раствора кислоты потребовалось 12 мл раствора щелочи. Чему равна нормальность раствора щелочи? 768. Вычислить молярную концентрацию раствора K2SO4, в 20, 0 мл которого содержится 1, 74 г растворенного вещества. Какова нормальная концентрация этого раствора? 769. До какого объема нужно довести раствор, содержащий 25, 0 г CuSO4, чтобы нормальная концентрация полученного раствора была 0, 50 н.? 770. Вычислить молярность 10%-ного раствора азотной кислоты, плотность которого 1, 056 г/мл. 771. Сколько миллилитров 10%-ного раствора хлорида бария ( 772. Сколько миллилитров 10% раствора соляной кислоты ( 773. Сколько миллилитров 20%раствора соляной кислоты ( 774. Вычислить, достаточно ли 20 мл 30% раствора серной кислоты ( 775. Сколько граммов NaOH необходимо взять для приготовления 125 мл 0, 15 M раствора? 776. Сколько миллилитров 70% H2SO4 (ρ =1, 622 г/мл) надо взять для приготовления 25 мл 2 M раствора? 777. Сколько граммов HNO3 содержится в 200 мл 0, 1 M раствора? 778. Чему равна молярность раствора, содержащего в 0, 75 л 4, 41 г поваренной соли? 779. В каком объеме 0, 1 M раствора содержится 7, 1 г Na2SO4? 780. Сколько граммов Na2CO3 содержится в 500 мл 0, 1 н. раствора? 781. Какова нормальная концентрация раствора, 800 мл которого содержат 12, 25 г H2SO4? 782. Сколько воды надо прибавить к 200 мл 1 н. раствора NaOH, чтобы получить 0, 05 н. раствор? 783. До какого объема следует упарить 3, 5 л 0, 04 н. раствора KOH для получения 0, 1 н. раствора? 784. До какого объема следует разбавить водой 2, 4 л 1, 6 н. раствор HCl для получения 0, 25 н. раствора? 785. Чему равна массовая доля H2SO4 в ее 10 н. растворе (ρ = 1, 29 г/мл)? 786. Смешаны 800 мл 3 н. раствора KOH и 1, 2 л 12% раствора KOH (ρ =1, 10 г/мл). Вычислить нормальную концентрацию полученного раствора. 787. Какой объём 40% (по массе) раствора H3PO4 ( 788. Рассчитайте молярность и нормальность 65% (по массе) раствора Pb(NO3)2 ( 789. Определите молярную и нормальную концентрацию 61, 4% (по массе) раствора MgSO4 ( 790. Титр раствора серной кислоты равен 0, 0049 г/мл. Какова нормальность этого раствора? 791. Какой объём 10% (по массе) раствора хлороводородной кислоты ( 792. На нейтрализацию 20 мл раствора H2SO4 израсходовано 25 мл 0, 005 н. раствора NaOH. Найдите титр и нормальность раствора кислоты. 793. Вычислите массовую долю 9 н. раствора KOH ( 794. Какую массу воды необходимо прибавить к 500 мл 20% (по массе) раствора NaCl ( 795. Какой объём 25% (по массе) раствора NaOH ( 796. Определите массовую долю раствора Na2CO3, полученного при растворении 12 г кристаллогидрата соды Na2CO3 · 10 H2O в 150 г воды. 797. Рассчитайте массу 5% (по массе) раствора MgSO4, для приготовления которого взято 400 г кристаллогидрата MgSO4 · 7H2O. 798. Сколько воды необходимо добавить к 3 л раствора с массовой долей KOH 50% ( 799. Какой объём 40% (по массе) раствора H3PO4 ( 800. Рассчитайте молярность и нормальность 65% (по массе) раствора Pb(NO3)2 ( 801. Смешаны 400 мл 1, 2 М раствора NaOH и 600 мл 1, 8 М раствора NaOH. Определите молярность полученного раствора. 802. Какую массу металлического висмута можно растворить в 70 мл 20% (по массе) раствора HNO3 ( 803. Вычислите молярность и нормальность 4, 6% (по массе) раствора буры Na2B4O7 ( 804. Какой объём раствора NaOH с массовой долей 25% ( 805. Определите массу хлорида кальция, необходимую для приготовления 2 л раствора ( 806. До какого объёма следует разбавить водой 2, 4 л 0, 03 н. раствора Na2SO4 для получения 0, 01н. раствора? 807. Рассчитайте объём 38% (по массе) раствора HCl ( 808. Какой объём 15% раствора H2SO4 ( 809. Определите молярную концентрацию 30% (по массе) раствора азотной кислоты ( 810. Растворимость NaCl при 250С равна 36, 0 г в 100 г воды. Определите массовую долю хлорида натрия в насыщенном растворе при этой же температуре. 811. Определите массу хлороводорода, который содержится в 0, 25 л раствора соляной кислоты с массовой долей HCl 15% ( 812. Рассчитайте мольные доли этилового спирта и воды в 96% (по массе) растворе С2Н5ОН. 813. Какую массу медного купороса CuSO4·5H2O и воды следует взять для приготовления 4 кг 20% (по массе) раствора сульфата меди (II) CuSO4? 814. Определите массовую долю раствора HNO3, если к 40 мл 96% раствора HNO3 ( 815. Какой объём 1 н раствора можно приготовить из 1кг 63% (по массе) раствора НNO3 (ρ = 1, 32 г/мл)? 816. Сколько граммов 2, 5% (по массе) раствора НCl требуется для взаимодействия со 150 мл 3 н раствора Na2CO3 (ρ = 1, 5 г/мл)? 817. Определите нормальность раствора, полученного смешением 400 мл 1, 2 н. и 600 мл 1, 8 н. раствора NaOH. 818. Определите массовую долю КСlO3 в насыщенном при 400С растворе, если растворимость бертолетовой соли при этой температуре равна 14г. 819. В 500 г воды растворили 100 л хлороводорода, измеренного при 200С и давлении 100 кПа. Вычислите массовую долю HCl в полученном растворе хлороводородной кислоты. 820. Какова молярность, нормальность и титр 20% (по массе) раствора КNO3 ( 821. Чему равны титр и массовая доля 5 н. раствора Н2SO4 ( 822. Какой объём 5 М раствора NaCl необходимо взять для приготовления 25 мл 4. н раствора хлорида натрия. 823. На нейтрализацию 50 мл раствора NaOH пошло 24 мл 0, 5 н. раствора серной кислоты. Какова нормальность раствора гидроксида натрия? 824. Определите массовую долю раствора, полученного при растворении 10 л (н. у.) сероводорода H2S в 400 г воды. 825. Какой объём 15% (по массе) раствора H2SO4 ( 826. Какую массу глауберовой соли Na2SO4·10 H2O следует растворить в 300 г воды для получения раствора, содержащего 5% (масс.) сульфата натрия? 827. Какой объём 0, 1 н. раствора серной кислоты можно приготовить из 150 мл 10% раствора H2SO4 (ρ = 1, 22 г/мл)? 828. На нейтрализацию 10 мл раствора щелочи израсходовано 30 мл 0, 2 н. раствора серной кислоты. Какова нормальность раствора щелочи? Сколько 0, 1 н. раствора HCl потребовалось бы для той же цели? 829. Какой объём 10% (по массе) раствора хлороводородной кислоты ( 830. На нейтрализацию 20 мл раствора H2SO4 израсходовано 25 мл 0, 015 н. раствора NaOH. Найдите титр и нормальность раствора кислоты. 831. Вычислите массовую долю 9 н. раствора KOH ( 832. Какую массу воды необходимо прибавить к 500 мл 20% (по массе) раствора NaCl ( 833. Определите массу хлорида кальция, необходимую для приготовления 2 л раствора ( 834. До какого объёма следует разбавить водой 2, 4 л 0, 03 н. раствора Na2SO4 для получения 0, 01 н. раствора? 835. Вычислите молярность и нормальность 5% (по массе) раствора буры Na2B4O7 ( 836. Какой объём раствора NaOH с массовой долей 45% ( 837. Какой объём 25% (по массе) раствора NaOH ( 838. Определите массовую долю раствора Na2CO3, полученного при растворении 12 г кристаллогидрата соды Na2CO3 · 10 H2O в 150 г воды. 839. Рассчитайте массу 5% (по массе) раствора MgSO4, для приготовления которого взято 400 г кристаллогидрата MgSO4 · 7H2O. 840. Сколько воды необходимо добавить к 3 л раствора с массовой долей KOH 50% ( 841. Определите массовую долю хлорида калия в растворе содержащем 0, 072г КС1 в 0, 3 л раствора плотность которого 1, 12 г/ мл. 842. Вычислите эквивалентную, молярную концентрации и моляльность раствора в котором массовая доля СаСО3 равна 5%. Плотность раствора равна 1, 12 г/мл. 843. Сколько воды необходимо прибавить к 100 мл 20% (по массе) раствора HCl (ρ =1, 10 г/мл), чтобы получить 5% (по массе) раствор? 844. Сколько миллилитров 30% (по массе) раствора HNO3 (ρ = 1, 205 г/мл) нужно взять для приготовления 0, 5 л 1 н. раствора? 845. Какой объем воды следует прибавить к 200 мл 50% (по массе) раствора НNОз (ρ = 1, 316 г/мл) для получения 10% (по массе) раствора. 846. К 500 мл раствора КОН с массовой долей 0, 36 (ρ = 1, 358 г/мл) добавили 125, 7 г КОН. Вычислите массовую долю полученного раствора. 847. Сколько граммов BaSО4 выпадет в осадок, если к 200 мл 0, 5 н раствора BaCl2 прибавить 50 мл 0, 3 н. раствора Na2SO4? 848. Титр раствора фосфорной кислоты равен 0, 02486 г/мл. Какой объем этого раствора потребуется для взаимодействия с 50 мл 0, 2 н. раствора КОН? 849. Вычислите объем воды, который необходимо прибавить к 100 мл 26%(по массе) раствора серной кислоты (ρ = 1, 190 г/мл), чтобы получить 5% раствор. 850. Смешали 100 мл раствора H2SО4 с массовой долей 0, 5 (ρ = 1, 399 г/мл) и 20 мл раствора H2SО4 с массовой долей 0, 1 (ρ = 1, 070 г/мл) и добавили воды до 2 л. Определите нормальность полученного раствора. 851. Вычислите объем раствора серной кислоты с массовой долей 0, 08 (ρ = 1, 055 г/мл), который необходим для приготовления 3 л 0, 1 н. раствора. Какова молярность приготовленного раствора? 852. Вычислите молярность, моляльность и нормальность 10% (по массе) раствора серной кислоты (ρ = 1, 069 г/мл). 853. Какой объем 0, 15 М раствора Н3РО4 можно приготовить из 55 мл 0, 45 н. раствора? Определите нормальность полученного раствора. 854. Какой объем 0, 2 н. раствора щелочи потребуется для осаждения в виде Fе(ОН)3 всего железа, содержащегося в 10 мл 0, 5 н. раствора FеС1з? Определите массу осадка. 855. Определить молярную и нормальную концентрации 16% (по массе) раствора NaOH (ρ =1, 18 г/мл). 856. На нейтрализацию 20 мл раствора NaOH потребовалось 40 мл 6% (по массе) раствора НС1 (ρ = 1, 029 г/мл). Вычислите нормальность раствора щелочи. 857. Чему равна молярная концентрация 20% (по массе) раствора HCl (ρ = 1, 10 г/мл)? 858. Сколько миллилитров 10% (по массе) раствора соляной кислоты (ρ = 1, 049 г/мл) нужно взять для приготовления 0, 1 л 0, 2 н. раствора? 859. До какого объема следует упарить 3, 5 л 0, 04 н. раствора KOH для получения 0, 1 н. раствора? 860. Сколько граммов KCl следует добавить к 450 г 8% (по массе) раствора той же соли для получения 12% (по массе) раствора? 861. До какого объема следует разбавить водой 2, 4 л 1, 6 н. раствор HCl для получения 0, 25 н. раствора? 862. Сколько миллилитров 96% (по массе) раствора H2SO4 (ρ = l, 84 г/мл) нужно взять для приготовления. 1 л 0, 5 н. раствора? 863. Чему равна массовая доля H2SO4 в ее 8 н. растворе (ρ = 1, 2 г/мл)? 864. Сколько миллилитров 70% (по массе) раствора H2SO4 (ρ = 1, 622 г/мл) надо взять для приготовления 70 мл 2 M раствора? 865. Сколько воды необходимо прибавить к 500 мл 20% (по массе) раствора NaCl (ρ = 1, 152 г/мл), чтобы получить 2, 5% (по массе) раствор? 866. Смешано 250 мл 0, 1 Mраствора H2SO4 и 100 мл 0, 5 Mраствора NaOH. Какое вещество и в каком избытке было взято? 867. Образец технической каустической соды содержит 92% (по массе) NaOH. Сколько по весу надо взять этого образца для приготовления 10 л 2 Mраствора NaOH? 868. Сколько миллилитров 0, 25 н. раствора H2SO4 потребуется для осаждения в виде BaSO4 всего бария, содержащегося в 20 мл 2 н. раствора BaCl2? 869. Сколько граммов KCl следует растворить в 100 г воды для получения 5% (по массе) раствора? 870. 1 мл34% (по массе) раствора содержит 0, 426 грастворенного вещества. Чему равна плотность этого раствора? 871. Насыщенный при 150C раствор K2CO3 (поташ) содержит 51, 3% (по массе) растворенного вещества (ρ =.1, 563 г/мл). Вычислить, сколько граммов K2CO3 содержится в 1 л такогораствора. 872. Сколько миллилитров 20% (по массе) раствора HCl (ρ = 1, 10 г/мл) следует добавить к 4 л 0, 6 н. раствора HCl для получения 1 н. раствора? 873. Сколько миллилитров 0, 1 н. раствора щелочи потребуется для осаждения в виде Fe(OH)3 всего железа, содержащегося в 200 мл 0, 2 н. раствора FeCl3? 874. Сколько литров 2, 5% (по массе) раствора NaOH (ρ = l, 03 г/мл) можно приготовить из 80 мл 35% (по массе) раствора (ρ = l, 38 г/мл)? 875. Чему равна молярная концентрация раствора, который содержит в 3 л 175, 5 г поваренной соли? 876. 600 млраствора NaOH содержат 8 грастворенного вещества. Чему равна молярность раствора? 877. На нейтрализацию 10 мл раствора щелочи израсходовано 30 мл 0, 6 н. раствора серной кислоты. Какова нормальность раствора щелочи? Сколько 0, 1 н. раствора HCl потребовалось бы для той же цели? 878. Для осаждения всего хлора, содержащегося в 15 мл раствора NaCl, израсходовано 35 мл 0, 1 н. раствора AgNO3. Сколько граммов NaCl содержит 1 л этого раствора? 879. Определите титр и нормальность 0, 7 н. раствора фосфорной кислоты. Какой объем этого раствора потребуется для взаимодействия с 45 мл 0, 1 н. раствора NaOH? 880. В 1000 г воды содержится 250 г КОН. Вычислите массовую долю, моляльную и нормальную концентрацию этого раствора. Плотность раствора 1, 156 г/мл. 881. Какой объем воды следует прибавить к 100 мл 40% (по массе) раствора НNОз (ρ = 1, 316 г/мл) для получения 10% (по массе) раствора. 882. К 500 мл раствора КОН с массовой долей 0, 36 (ρ = 1, 358 г/мл) добавили 15, 7 г КОН. Вычислите массовую долю полученного раствора. 883. Вычислите объем воды, который необходимо прибавить к 100 мл 26% (по массе) раствора серной кислоты (ρ = 1, 190 г/мл), чтобы получить 5% (по массе) раствор. 884. Смешали 100 мл раствора H2SО4 с массовой долей 0, 5 (ρ = 1, 399 г/мл) и 20 мл раствора H2SО4 с массовой долей 0, 1 (ρ = 1, 070 г/мл) и добавили воды до 3 л. Определите нормальность полученного раствора. 885. Вычислите массовую долю азотной кислоты в растворе и моляльность 8 н. раствора азотной кислоты (ρ = 1, 246 г/мл). 886. Смешаны 200 мл 1, 2 М раствора гидроксида натрия и 800 мл 1, 8 М раствора NaOH. Какова молярная концентрация полученного раствора? 887. Водный раствор содержит 577 г серной кислоты в 1 литре (ρ = 1, 335 г/мл). Вычислите массовую долю, молярную концентрацию, моляльность и мольные доли серной кислоты и воды в полученном растворе. 888. Определите эквивалентную концентрацию, моляльность и массовую долю сульфата железа (III) в растворе 0, 8 М раствора сульфата железа (III), если плотность раствора равна 1, 01 г/ мл. 889. В растворе объемом 200 мл содержится гидроксид натрия массой 12 г. Определите молярную концентрации и титр данного раствора. 890. Сколько мл 6 М раствора H3PO4 необходимо взять для приготовления из него раствора кислоты объемом 0, 5 л с эквивалентной концентрацией 0, 1 моль/л? 891. До какого объема нужно разбавить 30% (по массе) раствор нитрата свинца (II) объемом 25 мл (ρ = 1, 33 г/мл), чтобы получить раствор соли с концентрацией СМ = 0, 2 моль/л и плотностью 1, 08 г/мл? 892. До какого объема следует разбавить раствор НС1 объемом 25 мл с эквивалентной концентрацией 6 моль/л, чтобы концентрация стала равной 0, 2 моль/л? 893. Вычислите эквивалентную массу двухосновной кислоты, в 12, 5 н растворе которой массовая доля этой кислоты 37% (ρ = 1, 664 г/мл.). Какая это кислота? Чему равны молярная концентрация, моляльность и титр раствора этой кислоты? 894. Какой объем раствора серной кислоты с массовой долей 96% (ρ = 1, 835 г/мл) нужно взять для приготовления 5 л 0, 5 н. раствора серной кислоты? 895. Смешаны 0, 8 л 1, 5 н раствора гидроксида натрия и 0, 4 л 0, 6 н раствора гидроксида натрия. Какова молярная концентрация полученного раствора? 896. Какой объем раствора фосфорной кислоты с массовой долей Н3РО4 36 % (ρ = 1, 216 г/мл) требуется для приготовления 13 литров 0, 15 н. раствора фосфорной кислоты. 897. Вычислите молярную, эквивалентную концентрации и моляльность раствора серной с массовой долей Н2SO4 20% (ρ = 1, 14 г / мл). 898. Какой объем раствора с массовой долей соляной кислоты 10% (ρ = 1, 049 г/мл) надо взять для приготовления раствора объемом 350 мл с молярной концентрацией 0, 2 моль /л? 899. В 45 г воды растворено 6, 84 г сахара. Вычислите молярные доли сахара и воды. 900. Рассчитайте эквивалентную концентрацию и титр раствора иодида калия 1 литр которого содержит 0, 0037 г иодида калия. Раздел VII. Коллигативные свойства растворов [ 1, с.; 2, с.105-110; 3, с. 205-208; 4, с.209-214; 5, с.132-140]
|

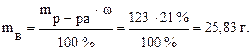

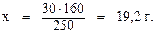

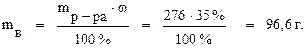

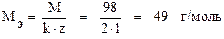 .
.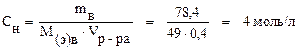 .
.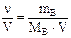
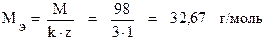 .
.
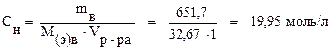 .
.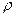 = 1, 31 г/мл).
= 1, 31 г/мл).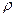 =1, 049 г/мл) нужно взять для приготовления 1 л 0, 2 н. раствора HCl?
=1, 049 г/мл) нужно взять для приготовления 1 л 0, 2 н. раствора HCl?


