Пример. 1. Водород при стандартных условиях газ, энтальпия образования газообразного водорода DfН0298= 0 кДж/моль
1. Водород при стандартных условиях газ, энтальпия образования газообразного водорода D fН 0298= 0 кДж/моль. 2. Ртуть при стандартных условиях жидкость, энтальпия образования жидкой ртути D fН 0298= 0 кДж/моль. 3. Углерод при 298 К может существовать в нескольких модификациях, например в виде графита и алмаза. Так как графит устойчивее алмаза, то (D fН 0298)графит = 0 кДж/моль, а (D fН 0298)алмаз = 1, 83 кДж/моль. Тогда стандартнаяэнтальпия образования сложных веществ (теплота образования) является количеством теплоты, которое поглощается или выделяется при образовании в стандартных условиях одного моля сложного вещества из простых веществ, взятых в наиболее устойчивой модификации: 1/2 А2 + 1/2 В2 = АВ + D fН 0298. Стандартная энтальпия образования веществ обозначается D fН 0298 [кДж/моль]; индекс f происходит от англ. formation – образование. Известные значения стандартных энтальпий образования веществ приведены в справочной литературе, в разделе термодинамические характеристики веществ. Теплота сгорания – это количество теплоты, которое выделяется при полном сгорании одного моля вещества при стандартных условиях. Полным сгоранием является реакция взаимодействия исходного вещества и кислорода с образованием продуктов окисления атомов, входящих в молекулу вещества. Принято считать, что продуктами окисления углерода, водорода, азота, галогенов (Hal), металлов (Ме) будут являться соответственно CO2, H2O (жидкость), N2, HHal, Me x O y. Пример. Реакция полного сгорания вещества C c H h N n O o F f имеет вид C c H h N n O o F f + x O2 = c CO2 + ( Стандартная энтальпия сгорания веществ обозначается D сН 0298, [кДж/моль]; индекс с происходит от английского combustion – сгорание. Следствия из закона Гесса. Теплоты образования и сгорания веществ широко используют при определении тепловых эффектов химических реакций. Расчеты проводят на основании следствий из закона Гесса. Первое следствие: тепловой эффект реакции равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ с учетом числа молей реагирующих веществ: D rН 0298=(å n i D fН 0 i)продукты–(å n i D fН 0 i)исх. вещества. Для реакции n аA + n bB = n сC + n dD тепловой эффект рассчитывается по уравнению D rН 0298=(n c × D fН 0 C + n d × D fН 0 D )–(n a × D fН 0 A + n b × D fН 0 B ). Второе следствие: тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции с учетом числа молей реагирующих веществ: D rН 0298=(å n i × D cН 0 i) исх. вещества –(å n i × D cН 0 i ) продукты . Для реакции n аA + n bB = n сC + n dD тепловой эффект рассчитывается по уравнению D rН 0298=(n a × D сН 0 A + n b × D сН 0 B)–(n c × D сН 0 C + n d × D сН 0 D).
|

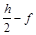 ) H2O +
) H2O + 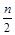 N2 + f HF.
N2 + f HF.


