Зависимость теплового эффекта реакции от температуры
Если системе, содержащей один моль вещества, сообщить элементарное количество теплоты d Q, то ее температура повысится на бесконечно малую величину dT: d Q = с × dT, соответственно Поскольку d Q зависит от пути процесса, то необходимо указать условия его протекания. Для изохорных и изобарных процессов соответственно различают теплоемкость при постоянном объеме cV (изохорная теплоемкость) и при постоянном давлении cp (изобарная теплоемкость):
Для нахождения изменения внутренней энергии или энтальпии вещества при изменении температуры системы от Т 1 до Т 2 необходимо интегрировать соответствующее уравнение. С практической точки зрения большее значение имеют химические процессы протекающие в изобарных условиях, тепловой эффект которых рассчитывают через изменение энтальпии. Используя справочные значения энтальпий образования веществ, можно рассчитать стандартный тепловой эффект реакции. Чаще всего на практике реакции протекают при температурах отличных от стандартной. Поэтому для расчета теплового эффекта необходимо учитывать изменение энтальпии при изменении температуры. Если в интервале от 298 К до температуры Т К нет фазовых переходов, то изменение энтальпии образования вещества составит величину:
Соответственно энтальпия образования вещества при температуре Т составит величину:
Если в температурном интервале имеются фазовые переходы, то при расчете необходимо учитывать изменение энтальпии вещества при фазовом переходе. При температуре фазового перехода происходит скачкообразное изменение энтальпии и теплоемкости вещества. При переходе от низкотемпературной фазы к высокотемпературной энтальпия увеличивается, а при обратном переходе уменьшается на ту же величину, которая называется энтальпией фазового перехода. Например, D mН 0 [кДж/моль] – энтальпия плавления (melting – плавление); D vН 0 [кДж/моль]– энтальпия испарения (vaporization – испарение). Пример. Изменение энтальпии одного моля воды при изобарном нагревании от Т 1< 0°С, до Т 2> 100°С (см. рис. 1.4):
ЗдесьD mH 0 – энтальпия плавления; D vH 0 – энтальпия испарения; (cp) i –изобарная теплоемкость каждой фазы. Часто для небольших температурных интервалов можно считать, что теплоемкость не зависит от температуры. В этом случае, используя среднее значение молярной теплоемкости D HТ 2–D HТ 2= При более точных расчетах необходимо учитывать зависимость изобарной теплоемкости от температуры. В температурной области» 300 К – 2000 К экспериментально определенную зависимость cp от Т аппроксимируют полиномами вида cp (Т)= а + b × Т + c × Т 2 +… или cp (Т)= а + b × Т + c¢ × Т –2 . Все коэффициенты для индивидуальных веществ и температурные области их использования приводятся в справочной литературе. Таким образом, тепловой эффект реакции при температуре Т по первому следствию из закона Гесса можно определить, учитывая зависимость энтальпии образования i -го вещества от температуры: D rН 0 Т =(å n i × (D fНТ) i)продукты–(å n i × (D fНТ) i)исх. вещества,
где D сp =(å n i × cpi)продукты–(å n i × cpi)исх. вещества; D rН 0298 – тепловой эффект реакции при стандартных условиях. Уравнения, позволяющие рассчитывать тепловой эффект реакции при температурах отличных от стандартной, называются уравнениями Кирхгофа (Kirchhoff). Отметим, что при использовании справочных данных по стандартным энтальпиям образования веществ необходимо принимать во внимание их фазовое (агрегатное) состояние, поскольку значения величин будут различаться на величину энтальпии фазового перехода. Пример. Для воды (H2O) в справочниках могут быть приведены значения стандартной энтальпии образования для трех агрегатных состояний (рис.1.4): · лед – D fН 0298кр = –291, 85 кДж/моль, D mН = 6, 013 кДж/моль – энтальпия плавления; · жидкость – D fН 0298ж = –285, 83 кДж/моль, D fН 0298ж=D fН 0298кр + D mН; D vН = 40, 683 кДж/моль – энтальпия испарения; · пар – D fН 0(298 К)г = –241, 81 кДж/моль, D fН 0298г=D fН 0298ж + D vН.
Рис. 1.4. Зависимость энтальпии образования одного моля воды D fHT от температуры
|

 ; с – молярная теплоемкость вещества, численно равная количеству теплоты, которое необходимо сообщить одному молю вещества для нагревания его на 1 К. Размерность молярной теплоемкости [Дж/моль× К].
; с – молярная теплоемкость вещества, численно равная количеству теплоты, которое необходимо сообщить одному молю вещества для нагревания его на 1 К. Размерность молярной теплоемкости [Дж/моль× К]. ,
,  .
. .
.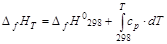 .
.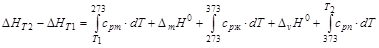 .
.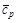 , изменение энтальпии одного моля вещества можно рассчитать по формуле
, изменение энтальпии одного моля вещества можно рассчитать по формуле ;
;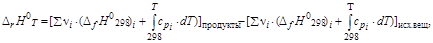
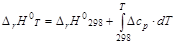 ,
,



