Скорость химической реакции
Под скоростью элементарной химической реакции подразумевается число элементарных актов (r), совершающихся в единицу времени в единице реакционного объема (для гомогенных реакций Пусть протекает гомогенная реакция, элементарный акт которой описывается уравнением n AA + n BB ® n DD. Из уравнения реакции вытекает, что в элементарном акте расходуется nA молекул вещества A и n В молекул вещества В с образованием n D молекул вещества D. Скорость реакции может быть определена как
где D ni – число частиц i -го вещества, взаимодействующих за интервал времени D t в объеме V, n i – стехиометрические коэффициенты. Отметим, что для простой реакции стехиометрические коэффициенты совпадают с числом частиц каждого вещества, участвующих в элементарном акте. Знак " минус" указывает на то, что вещество расходуется, а знак " плюс" – что оно накапливается в ходе реакции. Обычно указывается изменение количества i -го вещества в единицу времени (скорость накопления или расходования). Если учесть, что за время реакции D t = t 2 –t 1 изменение числа частиц реагентов в единице объема (
Мгновенная (истинная) скорость реакции определяется при D t ®0:
В смесях газов число частиц компонентов в единице объема пропорционально их парциальному давлению (pi): D ni =Dn i× NА, D pi× V =Dn i× RT (Dn i – изменение числа молей i -го газа; V – объем газовой смеси). Таким образом, для гомогенных реакций между газами скорость химической реакции можно выразить через изменение парциального давления i -го газа:
Соответственно при D t ®0
|

 ) или на единице реакционной поверхности (для гетерогенных реакций
) или на единице реакционной поверхности (для гетерогенных реакций 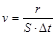 ). Непосредственно определить число элементарных актов достаточно трудно (или невозможно). Поэтому обычно скорость реакции выражают через величины, пропорциональные числу элементарных актов. Для гомогенных реакций такими величинами являются изменения молярных концентраций реагирующих веществ (число молей в единице объема).
). Непосредственно определить число элементарных актов достаточно трудно (или невозможно). Поэтому обычно скорость реакции выражают через величины, пропорциональные числу элементарных актов. Для гомогенных реакций такими величинами являются изменения молярных концентраций реагирующих веществ (число молей в единице объема). ,
, ) пропорционально изменению их молярных концентраций (
) пропорционально изменению их молярных концентраций ( [моль/л]), то среднюю скорость реакции можно выразить через изменение молярной концентрации i -го вещества. Тогда
[моль/л]), то среднюю скорость реакции можно выразить через изменение молярной концентрации i -го вещества. Тогда .
. .
. .
. .
.


