Химический потенциал
Энергетические превращения, происходящие в системах при совершении процессов в различных условиях, описываются с использованием соответствующих термодинамических функций U, H, G, A. Необходимо отметить, что эти функции вводились для идеального процесса, в котором количество каждого вещества считалось неизменным и равным одному молю. Однако их величины должны зависеть от количества данного вещества в системе, которое может изменяться в ходе процесса. Например, в замкнутой системе при протекании химической реакции уменьшается количество исходных веществ и увеличивается количество продуктов при сохранении общей массы вещества (меняется качественный и количественный состав системы). Для учета влияния этого обстоятельства на величины термодинамических функций было введено понятие химического потенциала. Приращение внутренней энергии системы при увеличении количества данного вещества в условиях постоянства энтропии системы и ее объема, при постоянстве количеств остальных веществ, получило название химический потенциал i-го вещества:
Можно показать, что величина химического потенциала i -го вещества определяется изменением термодинамической функции при изменении количества данного вещества на один моль в процессах, протекающих при постоянстве соответствующих параметров и неизменном количестве остальных веществ:
В изобарно-изотермических процессах изменение энергии Гиббса при изменении количества i -го вещества будет определяться выражением dG =m i× dni. При протекании химической реакции изменяются количества всех веществ, участвующих в реакции, поэтому dG =Sm i× dni. Условием равновесия химической реакции, происходящей в изобарно-изотермических условиях, D rG =0, следовательно, Sm i× dni = 0. Для реакции n аA + n bB = n сC + n dD условием равновесия будет Sm i× n i = 0, (m c× n C + m d× n D)–(m a× n A + m b× n B)=0. Очевидно, что химический потенциал i -го вещества будет зависеть от его количества в единице объема – от концентрации вещества. Эту зависимость можно получить, рассмотрев изменение энергии Гиббса при изобарно-изотермическом смешивании двух идеальных газов. Пусть два идеальных газа, находящихся в стандартных условиях, разделены перегородкой и занимают объемы V 1 и V 2 соответственно (рис.1.5). Количество первого газа равно одному молю (n1=1), а второго n2. Если убрать перегородку, происходит смешивание газов в результате взаимной диффузии. Каждый газ займет весь объем системы, и объем каждого составит V 1 + V 2. При этом концентрация каждого газа (количество вещества в единице объема) уменьшится. Каждый газ совершит работу расширения при постоянном давлении и температуре. Очевидно, что в результате этого процесса энергия Гиббса системы уменьшится на величину совершенной работы расширения.
Рис. 1.5. Смешивание двух идеальных газов в изобарно-изотермических условиях в результате взаимной диффузии
Изменение энергии Гиббса в результате уменьшения концентрации первого газа будет равно его работе расширения. Работа расширения первого газа определяется следующим образом: dA = p 0× dV, учитывая, что p × V =n× R × T и n1=1,
Поскольку равные объемы идеальных газов содержат одинаковое число молей вещества,
где X 1 – мольная доля 1-го газа; p 1 – парциальное давление 1-го газа; р 0 = 1, 013× 105 Па – стандартное давление; С 1 – молярная концентрация 1-го газа; С 0=1 моль/л стандартная концентрация. Таким образом, энергия Гиббса 1-го газа изменится на величину D G 1= R × T × ln X 1. Поскольку n1=1 моль, то, очевидно, D fGi T =D fG 0 i T + R × T × ln Xi. Таким образом, химический потенциал вещества зависит от его концентрации в смеси: m i =m i 0 + R × T × lnX i, m i =m i 0 + R × T × ln Необходимо отметить, что данные концентрационные зависимости химического потенциала характеризуют идеальные газы и растворы. Межмолекулярные взаимодействия в реальных газах и растворах приводят к отклонению расчетных химических потенциалов от величин, полученных для идеальных систем. Для учета этого вводятся понятия фугитивности иактивности. Фугитивность f (летучесть) – термодинамическая величина, служащая для описания свойств реальных газовых смесей. Она позволяет применять уравнения, выражающие зависимость химического потенциала идеального газа от температуры, давления и состава системы. При этом парциальное давление компонента газовой смеси pi заменяется на его фугитивность fi. Межмолекулярное взаимодействие приводит к уменьшению значения эффективного парциального давления компонента газовой смеси. Для учета этого величина парциального давления умножается на коэффициент фугитивности (g i < 1).Очевидно, что при pi ®0 g i ®1 и fi ® pi. В отличие от идеальных, в реальных растворах имеются межмолекулярные взаимодействия и взаимодействия между ионами, образующимися в результате электролитической диссоциации. Это приводит к тому, что эффективная концентрация молекул и ионов в реальных растворах уменьшается. Поэтому при вычислении химического потенциала используют вместо концентрации С величину активности а. Активность и молярная концентрация i -го компонента связаны соотношением аi =g i × Сi, где g i – молярный коэффициент активности (g i < 1). Очевидно, что при Сi ®0 g i ®1 и аi ® Сi.
|

 .
.

 .
.
 ® A =– R × T × ln
® A =– R × T × ln  .
. ,
, , m i =m i 0 + R × T × ln
, m i =m i 0 + R × T × ln 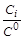 .
.


