Типовая задача. В 250 мл воды растворили 8 гхлорида меди(II) CuCl2
В 250 мл воды растворили 8 гхлорида меди(II) CuCl2. Рассчитать массовую и мольную доли растворенного вещества, молярную, моляльную, нормальную концетрации и титр полученного раствора. Плотность полученного раствора 1, 17 г/мл Для данного раствора рассчитать физико-химические параметры при температуре 25°С. Степень электролитической диссоциации 0, 9. Решение. 1. Определяем массовую долю растворенного вещества в полученном растворе Массовая доля показывает, сколько грамм растворенного вещества приходится на 100 г раствора
Найдем массу полученного раствора, она будет складываться из массы воды и массы хлорида меди, как растворенного вещества: m (раствора) = m(H2O) + m (CuCl2), зная что плотность воды ρ (H2O)=1г/мл; m(H2O) = ρ (H2O) ·V(H2O), m(H2O) = 1· 250 = 250 г, m (раствора)=250 + 8=258 (г).
2. Рассчитываем молярную концентрацию раствора: Молярная концентрация показывает, сколько моль растворенного вещества содержится в 1 л раствора
n – количество растворенного вещества, моль; V – объем раствора, л. Находим количество моль растворенного вещества
и объем раствора
Подставляя полученные значения в выражение для молярной концентрации, получаем:
3. Рассчитываем нормальную (эквивалентную) концентрацию раствора Нормальная концентрация показывает, какое число эквивалентов растворенного вещества содержится в 1 л раствора
nэ– количество моль эквивалентов растворенного вещества; V – объем раствора, л.
Рассчитываем nэ для рассматриваемого раствора
mэ (CuCl2) –эквивалентная масса CuCl2, г/моль
4. Рассчитываем моляльную концентрацию Моляльная концентрация показывает, сколько моль растворенного вещества приходится на 1 кг растворителя
m(раств-ля) – это масса растворителя, кг
5. Рассчитываем мольную долю растворенного вещества – это отношение количества моль растворенного вещества к общему числу моль в растворе
Найдем число моль воды:
5. Рассчитываем титр раствора, который показывает, сколько грамм растворенного вещества содержится в 1 мл раствора
7. Поскольку CuCl2 является электролитом, используем законы Рауля и Вант-Гоффа с введением поправочного коэффициента (изотонический коэффициент). Величина изотонического коэффициента зависит от степени диссоциации электролита:
α – степень диссоциации электролита; N – число ионов, на которые распадается электролит при диссоциации.
Хлорид меди при диссоциации распадается на три иона: CuCl2 ↔ Сu2+ + 2Cl- Рассчитываем величину изотонического коэффициента для рассматриваемого раствора: i = 0, 9·(3 - 1) + 1 = 2, 8 Рассчитываем величину осмотического давления для данного раствора.
P - осмотическое давление, кПа; i – изотонический коэффициент; СМ – молярная концентрация раствора, моль/л; R – универсальная газовая постоянная (8, 31 Дж·моль-1·К-1); Т – температура, К. P = 2, 8·0, 27·8, 31·298=1872 кПа 8. Рассчитываем величину понижения давления пара над раствором, используя I-й закон Рауля:
Δ р – изменение давления насыщенного пара над раствором, кПа; р0 – давление насыщенного пара над чистым растворителем; Х – мольная доля растворенного вещества в растворе.
9. Повышение температуры кипения и понижение температуры кристаллизации рассчитываем, используя II-й закон Рауля: Δ tкип = i·К·Сm Δ tкрист =i·Е·Сm, где
К и Е – соответственно криоскопическая и эбуллиоскопическая постоянные растворителя, °С (Кводы = 1, 86°С, Еводы = 0, 52°С); Сm – моляльная концентрация раствора.
Δ tкип = 2, 8·1, 86·0, 24 = 1, 25°С Δ tкрист =2, 8·0, 52·0, 24 = 0, 35°С Ответ: Δ tкип = 1, 25°С, Δ tкрист = 0, 35 °С.
Варианты заданий Таблица 5
|



 , где
, где


 , где
, где , где
, где


 , где
, где




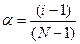 отсюда
отсюда  , где
, где , где
, где , где
, где
 ,
,  ,
,  ,
,  ,
,  ,
,  , P = 1872 кПа,
, P = 1872 кПа,  ,
,


