Типовая задача. Рассчитать ЭДС гальванического элемента состоящего из электродов: а) Zn/ZnSO4 (0,1М) и Ni/NiSO4 (0,01M);
Рассчитать ЭДС гальванического элемента состоящего из электродов: а) Zn/ZnSO4 (0, 1М) и Ni/NiSO4 (0, 01M); б) Ag/AgNO3 (1M) и Ag/AgNO3 (0, 1M). Составить схемы гальванических элементов, описать процессы, протекающие на катоде и аноде.
Решение. а) Рассматриваемый гальванический элемент является химическим, т.е. разница потенциалов достигается за счет разной химической природы электродов. ЭДС гальванического элемента определяется разницей потенциалов катода и анода. Пользуясь значениями таблицы П.2, в приложении находим значения стандартных потенциалов цинкового и никелевого электродов: φ 0(Zn2+/Zn0) = -0, 76 В φ 0(Ni2+/Ni0) = - 0, 25 В Рассчитываем реальные потенциалы рассматриваемых электродов при указанных в условии задачи концентрациях, используя уравнение Нернста:
n – количество электронов, участвующих в электродной полуреакции; [Zn2+] и [Ni2+] – концентрации катионов цинка и никеля в растворе, составляющем электрод. Рассчитав потенциалы электродов, составляющих гальванический элемент, можем сделать вывод, что цинковый электрод в данном элементе является анодом, а никелевый – катодом, т.к. φ Ni2+/Ni0 > φ Zn2+/Zn0
Записываем уравнения процессов, протекающих на катоде и аноде: на никелевом электроде будет происходить восстановление (+) К: Ni2+ + 2е- = Ni0 на цинковом электроде – окисление (-) А: Zn0 = Zn2++ 2е- Токообразующая реакция: Ni2+ + Zn0 = Ni0 + Zn2+
Рассчитываем ЭДС:
ε = φ к - φ а = φ Ni2+/Ni0 - φ Zn2+/Zn0 = -0, 31 – (-0, 79) = 0, 48 В
Составляем схему гальванического элемента:
(-) Zn | ZnSO4 (0, 1М) || NiSO4 (0, 01M) | Ni (+)
б) Рассматриваемый гальванический элемент является концентрационным, т.е. разница потенциалов достигается за счет разницы концентраций растворов соли в составе электродов. ЭДС рассчитывается аналогично ЭДС химического гальванического элемента. Пользуясь таблицей П.2, находим значение стандартного потенциала серебряного электрода: φ 0Ag+/Ag0 = 0, 80 В Используя уравнение Нернста, определяем потенциалы электродов при заданных концентрациях. Обозначим потенциал электрода Ag/AgNO3 (1M) – φ 1, а электрода Ag/AgNO3 (0, 1M) – φ 2. Потенциал φ 1 будет равен стандартному потенциалу серебряного электрода, т.к. [Ag+] = 1 моль/л φ 1 = 0, 80 В Для второго электрода потенциал рассчитываем, используя уравнение Нернста:
Электрод Ag/AgNO3 (1M) в данном элементе является катодом, Ag/AgNO3(0, 1M) –анодом, т.к. φ 1 > φ 2 На первом электроде будет происходить восстановление: (+) К: Ag+ + е- = Ag0 на втором – окисление: (-) А: Ag0 = Ag+ + е-
Рассчитываем ЭДС гальванического элемента
ε = φ к - φ а = φ 1 - φ 2= 0, 80 - 0, 74 = 0, 06 В и составляем его схему
(-) Ag | AgNO3 (0, 1M) || AgNO3 (1M) | Ag (+)
Варианты заданий Таблица 10
|


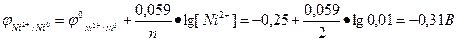 , где
, где



