Типовая задача. Вычислить константу равновесия для гомогенной системы
Вычислить константу равновесия для гомогенной системы 2SO2(г) + O2(г) ↔ 2SO3(г), если равновесные концентрации реагирующих веществ равны между собой и составляют 2 моль/л. Рассчитать изменение скорости прямой и обратной реакций при увеличении и уменьшении объема равновесной смеси в 3 раза. Как изменится скорость прямой реакции при изменении температуры от 30° до 70°С, если температурный коэффициент равен 2.
Решение. 1. Запишем выражение для константы равновесия данного процесса: [SO3], [SO2], [O2] – равновесные концентрации соответственно оксида серы (VI), оксида серы (IV) и кислорода. Подставляем числовые значения равновесных концентраций и рассчитываем константу равновесия:
1. Рассчитываем изменение скорости (υ) прямой и обратной реакций при изменении объема. Запишем выражения закона действующих масс для расчета скорости прямой и обратной реакций до изменения объема:
Уменьшение объема смеси равносильно увеличению концентрации реагирующих веществ. В соответствии с этим запишем новые выражения для расчета скорости прямой и обратной реакций:
Сравнивая скорости до и после уменьшения объема, получаем:
Скорость прямой реакции возросла в 27 раз, а скорость обратной – в 9 раз, соответственно, равновесие сместится в сторону продуктов реакции. 2. Зависимость скорости химической реакции от температуры определяется эмпиричеким правилом и уравнением Вант-Гоффа:
υ t1 и υ t2 - скорость реакции при температуре t1 и t2; γ – температурный коэффициент реакции.
Применительно к рассматриваемой задаче:
Следовательно скорость реакции, с увеличением температуры на 40°С, увеличится в 16 раз. Варианты заданий Таблица 4
|

 , где
, где
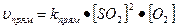





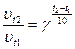 , где
, где



